Formule izobaričnih procesov, enačbe, poskusi, vaje

- 2917
- 13
- Dexter Koch
V izobarični proces, pritisk Str sistema ostaja konstanten. Predpona "ISO" prihaja iz grščine in se uporablja za označevanje, da nekaj ostane konstantno, medtem ko "baros", tudi iz grščine, pomeni težo.
Isobarični procesi so zelo lastni tako v zaprtih posodah kot v odprtih prostorih, saj jih je preprosto najti v naravi. S tem mislimo, da so na zemeljski površini ali kemičnih reakcijah v odprtih posodah do atmosfere možne fizikalne in kemične spremembe.
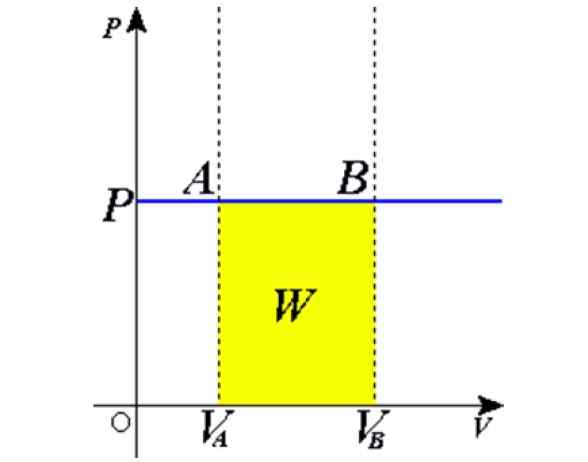 Slika 1. Izobarični postopek: Modra vodoravna črta je izobara, kar pomeni stalen tlak. Vir: Wikimedia Commons.
Slika 1. Izobarični postopek: Modra vodoravna črta je izobara, kar pomeni stalen tlak. Vir: Wikimedia Commons. Nekaj primerov dobimo s segrevanjem na soncu balon, poln zraka, kuhanje, vrelo ali zamrzovalno vodo, paro, ki nastane v kotlih, ali postopek dvigovanja balona z vročim zrakom. Kasneje bomo predstavili te primere.
[TOC]
Formula in enačbe
Za izobarični proces izhajamo iz enačbe, ob predpostavki, da je študijski sistem idealen plin, dokaj primeren model za skoraj vsak plin pri manj kot 3 tlačni atmosferi. Idealni delci plina se premikajo naključno, zasedajo celotno prostornino prostora, ki jih vsebuje, ne da bi se medsebojno medsebojno medsebojno povezali.
Če se idealni plin, zaklenjen v valj, ki je opremljen s premičnim batom. Nato plin nastopi na območju bata Do sila F Velikost:
F = p.Do
Kje str Je tlak plina. Ta sila izvaja delo, ki proizvaja neskončno majhno premik Dx V batu, ki ga daje:
dw = fdx = pa.Dx
Kot izdelek Adx Je volumski diferencial DV, tako Dw = pdv. Obe strani ostaja iz začetne glasnosti VDo Do končnega zvezka VB Za pridobitev skupnega dela, ki ga opravi plin:


[TOC]
Poskusi
Opisana situacija je preverjena eksperimentalno konfiguriranje plina znotraj valja, ki je opremljen s premičnim batom, kot je prikazano na slikah 2 in 3. Na batu je postavljen bat, katerega teža je usmerjena navzdol, medtem ko plin prisili pri sili zaradi tlaka P, ki nastane na batu.
Lahko vam služi: IMANTATION: Kaj je sestavljeno, metoda in primeri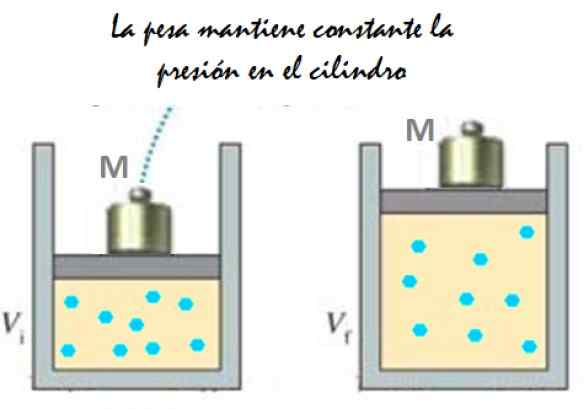 Slika 2. Eksperiment, ki je sestavljen iz širjenja konstantnega tlačnega plina. Vir: f. Zapata.
Slika 2. Eksperiment, ki je sestavljen iz širjenja konstantnega tlačnega plina. Vir: f. Zapata. Ker se bat lahko prosto premika, se lahko prostornina, ki jo zaseda plin, spremeni brez težav, vendar tlak ostane konstanten. Dodajanje atmosferskega tlaka pBankomat, To tudi pri silo navzdol, imate:
Mg - str.A + pBankomat . A = konstanta
Zato: p = (mg/a) + pBankomat Se ne razlikuje, razen če je m in z njim spremenjena. Če dodate toploto v jeklenko, se bo plin povečal povečal svojo količino ali pa se bo pri odvzemu toplote skrčil.
Izobarični procesi v idealnem plinu
Idealna enačba stanja plina se nanaša na pomembne spremenljivke: tlak P, volumen V in temperatura T:
Str.V = n .R.T
Tu n predstavlja število molov, R pa je konstanta idealnih plinov (veljavna za vse pline), ki se izračuna tako, da pomnoži Boltzmannovo konstanto s številko Avogadro, kar ima za posledico:
R = 8.31 j/mol k
Ko je tlak konstanten, lahko enačbo stanja zapišemo kot:
V/t = nr/p
Toda NR/P je konstanten, saj sta n, r in p. Ko sistem preide iz ene države 1 v drugo državo 2, se pojavi naslednji delež, znan tudi kot Charlesov zakon:
V1/T1 = V2/T2
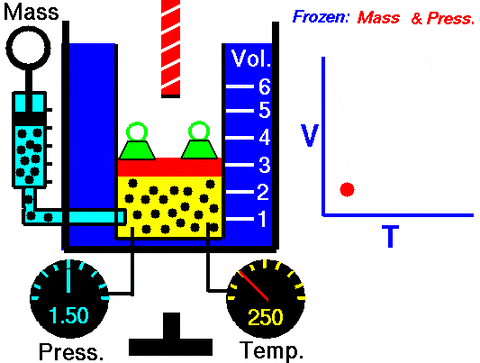 Slika 3. Animacija, ki prikazuje širitev konstantnega tlačnega plina. Na desni graf glasnosti, odvisno od temperature, ki je črta. Vir: Wikimedia Commons. Nasin raziskovalni center Glenn [javna domena].
Slika 3. Animacija, ki prikazuje širitev konstantnega tlačnega plina. Na desni graf glasnosti, odvisno od temperature, ki je črta. Vir: Wikimedia Commons. Nasin raziskovalni center Glenn [javna domena]. Zamenjava W = pΔV, Delo, opravljeno za prehod iz stanja 1 do 2, glede na konstante in temperaturno nihanje, ki ga je enostavno meriti s termometrom:
W1 → 2 = nr (t2 - T1) = nr.ΔT
Po drugi strani pa prvi zakon termodinamike ugotovi, da:
∆U = Q - W
To pomeni, da se dodajanje plina določena količina toplote Q poveča notranja energija ∆U in vibracije njegovih molekul se povečajo. Na ta način se plin širi in opravlja delo z izpodrivanjem bata, kot smo že rekli.
V idealnem monoatomskem plinu in variaciji notranje energije ∆U, ki vključuje tako kinetično energijo in potencialno energijo njegovih molekul, je:
∆U = (3/2)Nr Δt
Končno združimo v enem izrazu, ki smo jih pridobili:
Q = ∆U + W = (3/2)Nr Δt + Št∆T = (5/2) Nr Δt
Alternativno to je mogoče napisati glede na maso m, temperaturno razliko in novo konstanto, imenovano Specifična toplota pri konstantnem tlaku je skrajšana cstr, katerih enote so j/mol k:
Vam lahko služi: Venera (planet)Q = m cstr ∆t
Primeri
V zaprtih posodah se ne izvajajo vsi izobarični procesi. Pravzaprav se pojavijo nešteti termodinamični procesi vseh vrst atmosferskega tlaka, zato so izobarični procesi zelo pogosti po naravi. To vključuje fizikalne in kemične spremembe na zemeljski površini, kemijske reakcije v zabojnikih z odprtimi odprtimi in še veliko več.
Da se izobarični procesi pojavijo v zaprtih sistemih.
To se je zgodilo v eksperimentu bata, ki se je zlahka premaknil, ko se je plin razširil. Enako se zgodi z zapisom plina v zabavi za zabave ali balona vročega zraka.
Tu imamo več primerov izobaričnih procesov:
Zavremo vodo in kuhamo
Vrela voda za čaj ali omake za kuhanje v odprtih posodah so dobri primeri izobaričnih procesov, saj se vsi razvijajo ob atmosferskem tlaku.
Pri segrevanju vode, temperature in volumna in če se nadaljuje toplota, se končno doseže vrelišča, v kateri se sprememba vodne faze spremeni. Medtem ko se to zgodi, temperatura ostane tudi konstantna 100 ° C.
Zamrzniti vodo
Po drugi strani je zamrzovalna voda tudi izobarični postopek, ne glede na to, ali se pozimi odvija v jezeru ali domači hladilnik.
Segrejte balon, poln zraka na sonce
Drug primer izobaričnega procesa je sprememba volumna balona, napihnjenega z zrakom, ko je izpostavljen soncu. Prva stvar zjutraj, ko ni zelo vroče, ima globus določen glasnost.
Ko čas mineva in se temperatura povečuje, se tudi globus segreva in vse to se zgodi pod stalnim pritiskom. Globe Material je dober primer meje, ki je dovolj prilagodljiv, da se zrak v notranjosti, ko se segreje, širi brez spreminjanja tlaka.
Izkušnje je mogoče izvesti tudi tako, da nastavite globus brez napihnjenosti na vrhuncu steklene steklenice, polne s tretjino vode, ki se segreje na Marijo Mariji. Takoj, ko se voda segreje, se balon takoj napihne, vendar je treba paziti, da se ne segreje preveč, da ne eksplodira.
Aerostatski balon
To je plavajoča ladja brez pogona, ki uporablja zračne tokove za prevoz ljudi in predmetov. Globe je običajno napolnjen z vročim zrakom, ki je hladnejši od okoliškega zraka, se dvigne in širi, zaradi česar je globus grobo.
Vam lahko služi: trojna točkaMedtem ko zračni tokovi neposredno do sveta, imajo gorilnike, ki se aktivirajo za ogrevanje plina, ko se želite vzpenjati ali vzdrževati višino, in se deaktivirajo, ko se spuščajo ali pristanejo. Vse to se zgodi pri atmosferskem tlaku, ki naj bi konstantno na določeni višini nedaleč od površine.
 Slika 4. Baloni vročega zraka. Vir: Pixabay.
Slika 4. Baloni vročega zraka. Vir: Pixabay. Kotli
V kotlih se para nastaja s segrevanjem vode in vzdrževanjem stalnega tlaka. Potem ta para opravi uporabno delo, na primer, ki ustvarja elektriko v termoelektričnih rastlinah ali deluje druge mehanizme, kot so lokomotive in vodne črpalke.
Rešene vaje
Vaja 1
Pri temperaturi 27 ° C je 40 litrov plina. Poiščite povečanje volumna pri dodajanju toplote izobárično, dokler ne doseže 100 ° C.
Rešitev
Charlesov zakon se uporablja za določitev končnega volumna, vendar je treba v Kelvinu izraziti pozornost: temperature je treba izraziti, samo dodajte 273 K:
27 ° C = 27 + 273 K = 300 K
100 ° C = 100 + 273 K = 373 K
Od:
V1/T1 = V2/T2 ⇒ v2 = T2(V1/T1) = 373 ° C (40 L/300 K) = 49.7 l
Končno je povečanje volumna v2 - V1 = 49.7 l - 40 l = 9.7 l.
Vaja 2
5 so dobavljene 5.00 x 103 J od energije do idealnega plina za izdelavo 2.00 x 103 J dela na vašem okolju v izobaričnem procesu. Prosimo, da najde:
a) Sprememba notranje energije plina.
b) sprememba volumna, če se zdaj notranja energija zmanjša za 4.50 x 103 J in 7 sta izgnana.50 x 103 J sistema, glede na konstanten tlak 1.01 x 105 Pa.
Rešitev
Uporabljen ∆U = Q - W in vrednosti, navedene v izjavi, so zamenjane: Q = 5.00 x 103 J in W = 2.00 x 103 J:
=5.00 x 103 J - 2.00 x 103 J = 3.00 x 103 J
Zato se notranja energija plina poveča za 3.00 x 103 J.
Rešitev b
Sprememba glasnosti najdete v opravljenem delu: W = p∆V:
∆U = Q - W = Q - P∆V
Izjava potrjuje, da se notranja energija zmanjšuje: ∆U= -4.50 x 103 J. Prav tako nam pove, da je določena količina toplote izgnana: q = -7.50 x 103 J. V obeh primerih negativni znak predstavlja zmanjšanje in izgubo, nato pa:
-4.50 x 103 J = -7.50 x 103 J - P∆V
Kje P = 1.01 x 105 Pa. Ker so vse enote v mednarodnem sistemu, je sprememba obsega jasna:
∆V = (-4.50 x 103 J +7.50 x 103 J)/ (- 1.01 x 105 Pa) = -2.97 x 10-2 m3
Ker je sprememba volumna negativna, to pomeni, da se je obseg zmanjšal, to je pogodbo.
Reference
- Byjou. Izobarični proces. Okreval od: byjus.com.
- Cengel in. 2012. Termodinamika. 7. izdaja. McGraw Hill.
- XYZ postopek. Preberite več o izobaričnem procesu. Okrevano od: 10proces.X in z.
- Serway, r., Vulle, c. 2011. Osnove fizike. 9na ed. Cengage učenje.
- Wikipedija. Plinski zakoni. Okrevano od: je.Wikipedija.org.

