Diklorometanska struktura, lastnosti, uporabe, toksičnost

- 1629
- 449
- Percy Feeney
On Diklorometan, Znan tudi kot metilen klorid, je organska spojina, katere kemijska formula je ch2Cl2. Konkretno gre za alkil halogenid, ki izhaja iz plina metana. Za razliko od metana je ta spojina brezbarvna in polarna tekočina.
Sprva ga je leta 1839 sintetiziral francoski kemik in fizik Henri Victor Regnault (1810-1878).
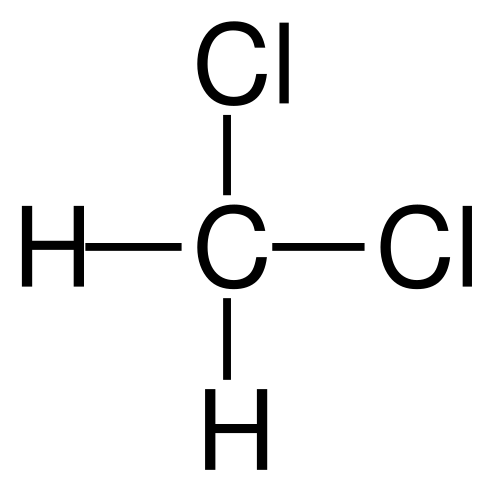 Strukturna formula diklorometana. Vir: Jü [javna domena]
Strukturna formula diklorometana. Vir: Jü [javna domena] Diklorometan se industrijsko pojavlja z obdelavo metana ali klorometana s klorovim plinom pri visoki temperaturi (400-500 ° C). Skupaj z diklorometanom se pojavljajo v procesu kloroform in ogljikovega tetraklorida, ki sta ločena z destilacijo.
Diklorometan se uporablja kot topilo, ki omogoča varjenje plastičnih materialov in razmaščeno kovine. Uporablja se tudi pri kavi in čajnem kofeinu.
Diklorometan je strupena spojina, ki lahko nastane z vdihavanjem nosnic in grla. O poškodbah jeter so poročali pri izpostavljenih delavcih visoki koncentraciji diklorometana. Poleg tega je mutageni agent, za katerega se sumi, da je rakotvorno.
[TOC]
Struktura
 Molekularna struktura diklorometana. Vir: Gabriel Bolívar prek Molview.
Molekularna struktura diklorometana. Vir: Gabriel Bolívar prek Molview. Na prvi sliki je bila prikazana strukturna formula CH2Cl2, v katerem izstopajo njihove kovalentne vezi C-H in C-CL. UP in njegova struktura, ki jo predstavlja model sfer in palic. Na prvi pogled upoštevajte, da so vezi C-H (bele kroglice) kratke, medtem ko so vezi C-CL (zelene kroglice) dolge.
Cho geometrija2Cl2 Je tetraedra; vendar izkrivljajo zaradi najbolj zajetnih atomov klora. En konec tetraedra sta opredeljena z dvema atoma klora, bolj elektronegativna kot vodik in ogljik. Zato v molekuli ch2Cl2 Ustanovljen je trajni dipolni trenutek (1.6D).
Vam lahko služi: reakcija nevtralizacijeTo omogoča, da se diklorometanske molekule medsebojno medsebojno medsebojno medsebojno spopadajo. Prav tako so te medmolekularne interakcije odgovorne za to spojino kot tekočina kljub nizki molekularni masi; Tekočina, ki pa je precej nestanovitna.
Lastnosti
Videz
Brezbarvna tekočina.
Molarna masa
84,93 g/mol.
Vonj
Sladko, podobno kot kloroform.
Prag vonja
205 - 307 ppm.
Gostota
1.3266 g/cm3 (20 ° C).
Tališče
- 97,6 ° C.
Vrelišče
39,6 ° C.
Topnost vode
25,6 g/l pri 15 ° C in 5,2 g/L A 60 ° C.
Diklorometan je komaj topen v vodi. Medtem ko obe molekuli, CHO2Cl2 in h2Ali pa so polarne, njihove interakcije so morda neučinkovite zaradi odbojnosti med atomi klora in kisika.
Topnost v drugih topilih
Mešljiv z etil acetatom, alkoholom, heksanom, benzenom, ogljikovim tetrakloridom, dietičnim etrom, kloroformom in dimetilformamidom.
Koeficient oktanola/vode
Dnevnik p = 1,19.
Parni tlak
57,3 kPa (25 ° C). Ta tlak ustreza približno 5,66 atm, kar odraža visok tlak pare.
Gostota pare
2.93 v zračnem razmerju, ki je vzet kot 1.
Indeks loma (πD)
1.4244 (20 ° C).
Goo
0,413 CP (25 ° C).
točka vžiga
Diklorometan ni vnetljiv, toda ko je pomešan z zrakom, tvori vnetljive hlape nad 100 ° C.
Temperatura samostojnosti
556 ° C.
Stabilnost
Je stabilen pri temperaturi okolice, če ni vlage, ima relativno stabilnost v primerjavi z njegovimi kongeneri: ogljikov tetrakloridni kloroform in tetraklorid.
Se nagiba k karboniziranju pri visokih temperaturah (300-450 ° C), ko njihovi hlapi pridejo v stik z jeklenimi in kovinskimi kloridi.
Razgradnja
Lahko ga razdelite v stik z vročimi površinami ali plamenom, oddajajo strupene in dražilne hlape fosgena in vodikovega klorida.
Vam lahko služi: diferencialni elektronKorozija
Diklorometan napade nekatere oblike plastike, gume in premazov.
Toplota za uparjanje
28,82 kJ/mol A 25 ° C.
Površinska napetost
28,20 Dynas/cm pri 25 ° C.
Reaktivnost
Diklorometan močno reagira z aktivnimi kovinami, kot so kalij, natrij in litij. Reagira z močnimi osnovami, na primer s kalijevim bouthexide. Je nezdružljiv s kavstičnimi snovmi, oksidanti in kemično aktivnimi kovinami.
Poleg tega reagira s tekočim kisikom v natrijevih in kalijevih zlitinah ter dušikovem tetroksidu. V stiku z vodo lahko zaženete nekaj nerjavečih jekel, niklja, bakra in železa.
Prijave
Večina uporabe in uporabe diklorometana temelji na njegovih lastnostih kot topilo. Zaradi te značilnosti se diklorometan uporablja v hrani, prometu, industriji proizvodnje medicine itd.
Predelava hrane
Diklorometan se uporablja v kavnih zrnih in čajnih listih brez kofeina. Uporablja se tudi za ekstrakcijo hmelja za pivo, pijačo in druge živilske zastave, pa tudi za predelavo začimb.
Farmacevtska industrija
Diklorometan se uporablja za pripravo cefalosporina in ampicilina, poleg proizvodnje antibiotikov, steroidov in vitaminov.
Fotografija
Uporablja se tudi kot topilo pri produkciji celuloznega triacetata (CTA), ki se uporablja pri ustvarjanju varnostnih filmov.
Elektronska industrija
To je idealna spojina za proizvodnjo tiskanih krožnikov z uporabo aluminijaste površine, preden dodate fotoret plošče.
Barve
Diklorometan je topilo, ki ga najdemo v lakov in v ločevalcih barv, ki se uporabljajo za odpravljanje lakov ali prevleke slik različnih vrst površin.
Prevoz
Služi za razmaščevanje kovinskih delov in površin, ki so prisotne v železniški opremi, pa tudi v komponentah zrakoplovov.
Vam lahko služi: destilirana vodaDruge uporabe
Uporablja se kot razpršilno pogonsko gorivo (aerosoli) in kot ekspanzijsko sredstvo za poliuretansko peno. Uporablja se tudi kot tekočina pri nekaterih vrstah božičnih luči.
Strupenost
Akutni učinki
Vdihavanje diklorometana lahko povzroči draženje zgornjih dihalnih poti, kašlja, piskanja ali pomanjkanja zraka.
Lahko proizvede rdečnost kože, in če spojina ostane že dolgo, povzroči kemične opekline. V stiku z očmi diklorometan povzroči močno draženje, ki se lahko razširi na opeklino.
Poleg tega deluje kot nevrotoksin, ki ustvarja vizualne, slušne in psihomotorne spremembe; Toda ti učinki so reverzibilni za prenehanje vdihavanja diklorometana.
Kronični učinki
Diklorometan lahko vpliva na centralni živčni sistem in ustvari glavobol, duševno zmedo, slabost, bruhanje in izgubo spomina.
Pri živalih povzroča škodljive učinke na jetra, ledvice, centralni živčni sistem in srčno -žilni sistem.
Takoj, ko karcinogeneza ni poročala o bistvenem povečanju smrti zaradi raka pri delavcih, ki so bili izpostavljeni diklorometanu. Vendar so študije na živalih pokazale povečanje, ki ga je mogoče pripisati diklorometanu v pojavnosti raka in pljuč jeter, pa tudi benigni tumorji mlečnih žlez.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5ta Izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10th Izdaja.). Wiley Plus.
- Nacionalni center za informacije o biotehnologiji. (2020). Diklorometan. Baza podatkov Pubchem., Cid = 6344. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Wikipedija. (2020). Diklorometan. Pridobljeno iz: v.Wikipedija.org
- Brumer. (14. julij 2018). Diklorometan. Okreval od: brumer.com
- MSDS na spletu. (2019). Nevarnosti in varnostne informacije o diklorometanu (metilen klorid). Pridobljeno iz: msdsonline.com
- EPA. (2000). Metilen klorid (diklorometan). [PDF]. Okrevano od: EPA.Gov
- « Določitev metod in primerov pepela
- Južnokorejska kulturna tradicija, običaji, gastronomija, religija »

