Anisol struktura, lastnosti, nomenklatura, tveganja in uporabe
- 3814
- 1034
- Lee Farrell
On anizol ali metoksibenzen Gre za organsko spojino, ki je sestavljena iz aromatičnega etra, katerega kemijska formula je c6H5Och3. Njegovo fizično stanje je brezbarvna tekočina, ki lahko predstavlja rumene barve. Zlahka ga prepozna svoj značilni vonj janeža.
Nato je hlapna spojina in ne zelo visoke kohezijske sile; Običajne značilnosti v lahkih etrih, ki so shranjene v majhnih zaprtih posodah. Konkretno, Anisol je najpreprostejši alkil auril eter; to pomeni tiste z aromatično komponento (AR) in drugim alkilom (R), AR-O-R.
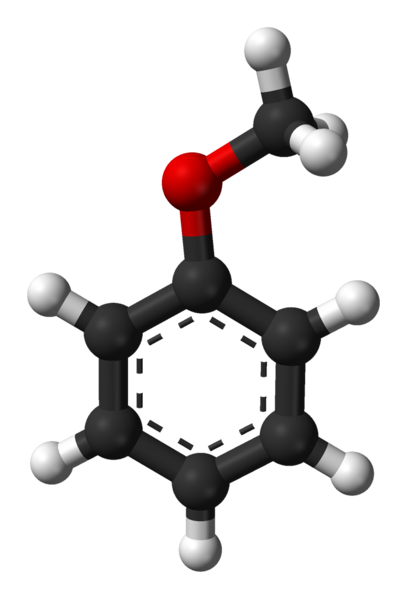
 Anisol molekula. Vir: Ben Mills prek Wikipedije.
Anisol molekula. Vir: Ben Mills prek Wikipedije. Skupina c6H5- Prihaja k označevanju AR in -CH3 A r, torej ima c6H5-O-ch3. Aromatični obroč in prisotnost -och3 Kot nadomestna skupina, imenovana Metoxi. Zato služi kot posredniška molekula za sintezo spojin s farmakološko aktivnostjo.
Njegov značilen vonj janeža je bil uporabljen za dodajanje anizola kozmetičnim in higienskim izdelkom, ki zahtevajo prijetno dišavo.
[TOC]
Anisol struktura
Na zgornji sliki je molekularna struktura anizola prikazana s pomočjo modela sfer in palic. Aromatični obroč je cenjen, katerih ogljikovi so sp2 in zato je ravno kot šesterokotni list; In povezan z njim, je skupina Metoxi, katere ogljik je sp3, in njeni vodiki so nad ali pod obročno ravnino.
Pomen skupine -och3 V strukturi presega prelom z ravno geometrijo molekule: daje ji polarnost in posledično benzenska apolarna molekula pridobi trajni dipolski trenutek.
Dipolarni trenutek
Ta dipolni trenutek je posledica atoma kisika, ki pritegne elektronsko gostoto tako aromatičnega kot metilnega obroča. Zahvaljujoč temu lahko Anisolove molekule medsebojno medsebojno vplivajo na napol dipolo; Čeprav nima nobene možnosti oblikovanja vodikovih mostov, ker je eter (ROR nima povezave s kisikom).
Vam lahko služi: natrijev klorid (NaCl)Njegova visoka vrelišče (154 ° C) eksperimentalno potrjuje močne medmolekularne interakcije, ki urejajo njegovo tekočino. Prav tako so prisotne londonske disperzijske sile, odvisne od molekulske mase in π -π interakcij med samimi obroči.
Kristali
Anisolova struktura pa mu ne dovoljuje.F = -37 ° C). To je lahko tudi posledica dejstva, da so med medmolekularnimi razdaljami elektrostatične odbojnosti med sosednjimi aromatičnimi obroči zelo močne.
Zato po kristalografskih študijah molekule anizola v kristalih pri temperaturi -173 ° C ni mogoče naročiti tako, da se njihovi obroči soočajo; to pomeni, da se njena aromatična središča ne ujemajo med seboj, ampak skupina -och3 Je gor ali pod sosednjim obročem.
Lastnosti
Fizični videz
Brezbarvna tekočina, vendar lahko to predstavlja blage barvne slamnate tone.
Vonj
Diši nekoliko podobno kot semena janeža.
Okus
Sladko; Vendar je zmerno strupen, zato je ta test nevaren.
Molekularna masa
108,140 g/mol.
Gostota
0,995 g/ml.
Gostota hlapov
3.72 (v zračnem razmerju = 1).
Tališče
-37 ° C.
Vrelišče
154 ° C.
točka vžiga
125 ° C (odprta skodelica).
Temperatura samostojnosti
475 ° C.
Goo
0,778 cp pri 30 ° C.
Površinska napetost
34,15 DINS/CM A 30 ° C.
Refrakcijska indica
1,5179 do 20 ° C.
Topnost
Slabo topno v vodi (približno 1 mg/ml). V drugih topilih, kot so aceton, ethers in alkoholi, je kljub temu zelo topno.
Nukleofilnost
Anisolov aromatični obroč je bogat z elektroni. To je zato, ker kisik, čeprav je zelo elektronegativni atom. Posledično več elektronov potuje po aromatičnem sistemu in zato poveča njeno nukleofilnost.
Lahko vam služi: kamforozni alkohol: struktura, formula, lastnosti in uporabeEksperimentalno je bilo povečanje nukleofilnosti dokazano s primerjavo njene reaktivnosti, ob aromatičnih elektrofilnih substitucijah, z benzenom. Tako je dokazan izjemen učinek skupine -och3 Na kemičnih lastnostih spojine.
Upoštevati je treba tudi, da se elektrofilne substitucije pojavljajo v sosednjih položajih (-orto) in nasproti (-for) do skupine Metoxi; to pomeni, da je to orto-za režiser.
Reaktivnost
Anisolova aromatična obroča nukleofilnost vam že omogoča, da pogledate, kako je njena reaktivnost. Zamenjave se lahko zgodijo bodisi v obroču (naklonjena njeni nukleofiličnosti) ali v isti skupini Metaxi; V slednjem je povezava O-ch pokvarjena3 Za zamenjavo -ch3 drugi alkilični skupini: o-Alquilación.
Zato lahko v procesu alkilacije Anisol sprejme skupino R (fragment druge molekule), ki nadomešča h obroča (C-živo) ali zamenja CH3 Iz skupine Metoxi. Naslednja slika prikazuje, kaj je pravkar rečeno:
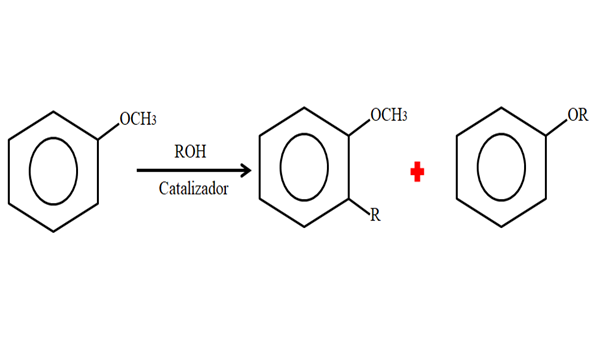 Anisol alkilacija. Vir: Gabriel Bolívar.
Anisol alkilacija. Vir: Gabriel Bolívar. Na sliki je skupina R nameščena v položaju -orto, lahko pa je tudi v položaju -za, nasprotno -och3. Ko se zgodi o -alquilación, dobimo nov eter z drugo skupino -Or.
Nomenklatura
Ime 'Anisol' je najbolj znano in sprejeto, najverjetneje izhaja iz njegovega vonja, podobnega janesu. Vendar je ime „metoksibenzen“ precej specifično, saj vzpostavlja nekoč strukturo in identiteto tega aromatičnega etra; To je ime, ki ga ureja sistematična nomenklatura.
Drugo manj uporabljeno ime, vendar enako veljavno, je "fenil metil eter", ki ga ureja tradicionalna nomenklatura. To je morda najbolj specifično ime od vseh, saj neposredno označuje dva strukturna dela etra: Phoenl-O-Metil, C6H5-O-ch3.
Tveganja
Medicinske študije še niso mogle pokazati možnih smrtnih učinkov anizola na telo pri nizkih odmerkih. Vendar pa, tako kot skoraj vse kemične snovi, tudi draži, ko je preveč čas izpostavljen in v zmernih koncentracijah na koži, grlu, pljučih in očeh.
Vam lahko služi: Amagat zakon: Pojasnilo, primeri, vajeTudi zaradi nukleofilnosti njegovega obroča je del tega presnavljan in je zato biorazgradljiv. Dejansko so simulacije zaradi te lastnosti pokazale, da se ne osredotoča na vodne ekosisteme, saj ga njeni organizmi najprej razgradijo; In zato lahko reke, jezera ali morja kopičijo anisol.
V tleh glede na svojo nestanovitnost hitro izhlapi in ga vlečejo zračni tokovi; Tako tudi rastlinske mase ali nasadi ne vplivajo znatno.
Po drugi strani pa atmosfersko reagira s prostimi radikali in zato ne predstavlja tveganja za onesnaževanje zraka, ki ga dihamo.
Prijave
Organska sinteza
Iz anizola lahko druge derivate dobimo z aromatično elektrofilno substitucijo. To omogoča uporabo kot posrednik za sintezo zdravil, pesticidov in topil, ki želijo dodati svoje značilnosti. Sintetične poti so lahko večinoma.
Dišave
Poleg uporabe za organsko sintezo se lahko uporablja neposredno kot dodatek za kreme, mazila in parfume, ki vključujejo proti dišave v takšne izdelke.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. Do. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. Amine. (10. izdaja.). Wiley Plus.
- Nacionalni center za informacije o biotehnologiji. (2019). Anizol. Baza podatkov Pubchem, CID = 7519. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Wikipedija. (2019). Anizol. Pridobljeno iz: v.Wikipedija.org
- Pereira, Cynthia c. M., De la cruz, Marcus h. C., & Lachter, Elizabeth R. (2010). Tekoča faselacija anizola in fenola, ki jo katalizira niobijev fosfat. Časopis Brazilskega kemijskega društva, 21 (2), 367–370. Dx.doi.org/10.1590/S0103-50532010000200025
- SEIDER R. W. in Goddard R. (2015). Anisol pri 100 K: Prva določitev kristalne strukture. Crystallogr c struct Chem Act. Avg; 71 (Pt 8): 664–6. Doi: 10.1107/S2053229615012553
- Kemična formulacija. (2018). Metoksibenzen. Obnovi se od: quimica formulacije.com

