Usposabljanje, razlike z anionom in primeri

- 1112
- 50
- Dexter Koch
A kation To je kemična vrsta, ki ima pozitiven naboj. Dve vrsti obstoječih ionov sta za anion. Njegova obremenitev je produkt pomanjkanja elektronov v atomu, zaradi česar so jedri protoni vadbijo večjo privlačnost. Za vsak elektron, ki izgubi nevtralen atom, se pozitivna obremenitev poveča v enoti.
Če atom izgubi elektron in je zato število protonov večje od enega, bo njegova pozitivna obremenitev +1; Če izgubite dva elektrona, bo obremenitev +2 in tako naprej. Kadar ima kation +1 obremenitev, naj bi bilo monovalentno; Po drugi strani pa je, če je omenjena obremenitev večja od +1, pravijo, da je kation vsestranski.
 Hydronio Ion, eden najpreprostejših kationov. Vir: Gabriel Bolívar.
Hydronio Ion, eden najpreprostejših kationov. Vir: Gabriel Bolívar. Na zgornji sliki je prikazan kationu H3Tudi+, imenovan Hydronio ion. Kot je razvidno, ima komaj obremenitev +1 v skladu z monovalentnim kationom.
Kationi so pomembne vrste, saj imajo elektrostatično silo s svojim okoljem in molekulami naokoli. Imajo visoko interakcijo z vodo, tekočino, ki hidrira in prevaža v mokrih tleh, nato pa dosežejo korenine rastlin in se uporabljajo za njihove fiziološke funkcije.
[TOC]
Kako nastane kation?
Omenjeno je bilo, da ko atom izgubi elektron, njegovo največje število protonov glede na elektrone izvaja privlačnost, ki pomeni pozitivno obremenitev. Kako pa lahko pride do izgube elektronov? Odgovor je odvisen od transformacije, ki se je pojavila v kemičnih reakcijah.
Treba je opozoriti, da prisotnost atoma s pozitivno obremenitvijo ne pomeni nujno tvorbe kation. Tako da ga je mogoče obravnavati kot takega, ne bi smelo biti atoma z negativno formalno obremenitvijo, ki nevtralizira. V nasprotnem primeru bi obstajala privlačnost in odbojnost znotraj iste spojine in bi bila nevtralna.
Vam lahko služi: kalcijev sulfat (case4): kemična struktura, lastnosti, uporabeFormalne stroške in več povezav
Elektronegativni atomi pritegnejo elektrone njihovih kovalentnih vezi do njih. Čeprav se elektroni delijo enako, obstaja točka, kjer bodo delno imeli manj elektronov kot v njihovi bazalni konfiguraciji; To je, da njihovi prosti atomi, ne da bi bili povezani z drugimi elementi.
Nato bodo ti elektronegativni atomi začeli doživljati pomanjkanje elektronov in z njim bodo protoni njihovih jeder izvajali večjo privlačnost; Pozitivna formalna obremenitev se rodi. Če obstaja le pozitivna formalna obremenitev, bo spojina pokazala globalno pozitivno ionsko obremenitev; Tako se je rodil kation.
Atom kisika kationa h3Tudi+ Je zvest primer zgoraj navedenega. S tremi O-H vezi, ena več kot v molekuli vode (H-O-H), doživi izgubo elektrona glede na njegovo bazalno stanje. Izračuni formalnih obremenitev omogočajo določitev, kdaj se to zgodi.
Če se za trenutek predvideva tvorba drugega O-H, bomo dobili dvovalentno kation4Tudi2+. Upoštevajte, da je dvovalentna obremenitev na vrhu kationa napisana na naslednji način: Številka je sledila simbolu '+'; Na enak način se anioni nadaljujejo.
Oksidacija
Kovine so kationske formatike par odličnost. Vendar ne morejo vsi oblikovati kovalentnih vezi (ali vsaj čisto kovalentne). Namesto tega izgubijo elektrone, da vzpostavijo ionske vezi: pozitivna obremenitev pritegne negativno, združene s fizičnimi silami.
Zato kovine izgubijo elektrone, da se premaknejo iz m na mn+, kje n Običajno je enak številu vaše skupine v periodični tabeli; čeprav n Lahko vzamete več celih vrednosti, ki se pojavljajo zlasti pri prehodnih kovinah. Ta izguba elektronov se izvede v vrsti kemijske reakcije, imenovane oksidacija.
Vam lahko služi: terciarni alkohol: struktura, lastnosti, primeriKovine oksidirajo, izgubijo elektron, število protonov njihovih atomov presega število elektronov in posledično kaže pozitivno obremenitev. Da bo oksidacija, mora obstajati oksidacijsko sredstvo, ki zmanjšuje ali pridobi elektrone, izgubljene s kovinami. Kisik je najbolj znano oksidacijsko sredstvo.
Razlike z anionom
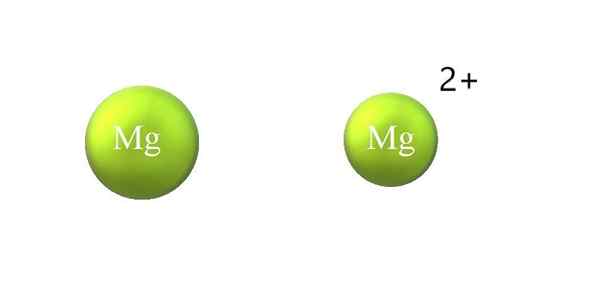 Krčenje atomskega polmera v kationu. Vir: Gabriel Bolívar.
Krčenje atomskega polmera v kationu. Vir: Gabriel Bolívar. Spodaj so razlike med kationom in anionom:
-Splošni kation je manjši od aniona. Zgornja slika prikazuje, kako se atomski polmer MG zmanjša z izgubo dveh elektronov in postati MG kation2+; Z anioni se zgodi nasprotno: postanejo bolj zajetni.
-Ima več protonov kot elektronov, medtem ko ima Anion več elektronov kot protonov.
-Ker je manjša, je njegova gostota obremenitve večja in ima zato večjo polarizacijsko moč; to pomeni, da deformira elektronske oblake sosednjih atomov.
-Kation se premika v isti smeri kot v uporabljenem električnem polju, anion pa v nasprotni smeri.
Primeri najpogostejših kationov
Monoatomski
Monoatomski kationi prihajajo večinoma iz kovin (razen določenih izjem, na primer H+). Od ostalih je izjemno redko upoštevati kation, ki izhaja iz nemetalnega elementa.
Videti bo, da so mnogi di ali vsestranski in da se veličine njihovih obremenitev strinjajo s številom njihovih skupin v periodični tabeli.
Lahko vam služi: ribulosa-1,5-bifosfat (rubp): značilnosti, karboliksacija-Li+
-Na+
-K+
-Rb+
-Cs+
-Fr+
-Ag+
Vsi imajo skupno obremenitev '1+', ki je napisana brez postavitve števila, in prihajajo tudi iz skupine 1: Alkalne kovine. Poleg tega je kation ag+, Ena najpogostejših prehodnih kovin.
-Biti2+
-Mg2+
-AC2+
-gospod2+
-Ba2+
-Ra2+
Ti dvovalentni kationi izhajajo iz njihovih kovin, ki pripadajo skupini 2: Alkalineriorne kovine.
-Do3+
-Ga3+
-V3+
-Tl3+
-Nh3+
Trivalentni kationi skupine Boro.
Za doslej je bilo za primere značilno eno samo valenco ali nalaganje. Drugi kationi imajo več kot eno valenčno ali pozitivno oksidacijsko stanje:
-Sn2+
-Sn4+ (kositer)
-Co2+
-Co3+ (kobalt)
-Au+
-Au3+ (zlato)
-Vera2+
-Vera3+ (železo)
In druge kovine, kot je mangan, imajo lahko še veliko več valen:
-Mn2+
-Mn3+
-Mn4+
-Mn7+
Večja bo obremenitev, manjša in polarizirajoča bo kation.
Poliatomično
Ne da bi se spuščali v organsko kemijo, obstajajo anorganski in polilamični kationi, ki so v vsakdanjem življenju zelo pogosti; kot naprimer:
-H3Tudi+ (Hydronio, že omenjen).
-Nh4+ (amonij).
-Ne2+ (Nitronio, prisoten v procesih nitracije).
-Ph4+ (Fosfonij).
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Čelada, Anne Marie, ph.D. (5. maj 2019). Definicija in primer kationa. Okreval od: Thoughtco.com
- Wyman Elizabeth. (2019). Kation: definicija in primer. Študij. Okrevano od: študij.com
- Lutke. (2019). Pozitivni in negativni ins: kationi in anioni. Okrevano od: lutke.com
- Wikipedija. (2019). Kation. Okrevano od: je.Wikipedija.org
- « Anisol struktura, lastnosti, nomenklatura, tveganja in uporabe
- Arheolitski izvor, značilnosti, podnebje, flora in favna »

