Struktura fosforja oksida (v), lastnosti, pridobivanje, uporaba, tveganja

- 3035
- 247
- Barry Ernser
On Fosforjev oksid (v) Gre za anorgansko trdno snov, ki jo tvorita fosfor (P) in kisik (O). Njegova empirična formula je p2Tudi5, Medtem ko je njegova pravilna molekularna formula p4Tudi10. Je zelo higroskopska bela trdna snov, to je, da lahko zelo enostavno absorbira zrak iz zraka, takoj reagira s tem. Reakcija je lahko nevarna, ker povzroči hitro povečanje temperature.
Njegova velika nagnjenost k absorpciji vode je povzročila, da se uporablja kot sušilno sredstvo v kemičnih laboratorijih, pa tudi dehidriranje nekaterih spojin, to je, da odstrani vodo iz svojih molekul.
 Prašek fosforja (V), str4Tudi10. Lhchem [cc by-s (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
Prašek fosforja (V), str4Tudi10. Lhchem [cc by-s (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons. Fosforjev oksid (V) se uporablja tudi za pospeševanje vezavnih reakcij molekul različnih ogljikovodikov, ki so reakcija, imenovana kondenzacija. Poleg tega omogoča pretvorbo določenih organskih kislin v estre.
Uporablja se na primer za izboljšanje bencina, za pripravo fosforne kisline H3Po4, Za pridobitev spojin, ki služijo za odlašanje požara, izdelavo stekla za vakuumske aplikacije, med številnimi drugimi uporabi.
Fosforjev oksid (v) je treba hraniti v dobro zamačenih posodah, da preprečimo stik z vlago iz zraka. Je jedko in lahko škodi očem, koži in sluznici.
[TOC]
Struktura
Fosforjev oksid (V) tvori fosfor (P) in kisik (O), kjer ima fosfor valenco +5 in kisik -2. Molekula fosforjevega oksida (V) ima štiri fosforus in deset kisikovih atomov, zato je njena pravilna molekularna formula p p p p p p p p p p p p p p p p p p p p p p p p p p p4Tudi10.
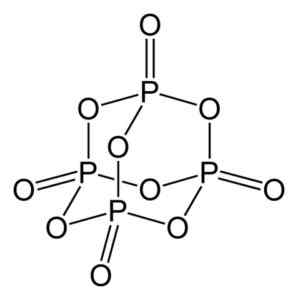 Struktura molekule fosforjevega oksida (v), str4Tudi10. Avtor: Benjah-BMM27. Vir: Wikimedia Commons.
Struktura molekule fosforjevega oksida (v), str4Tudi10. Avtor: Benjah-BMM27. Vir: Wikimedia Commons. Obstaja v treh kristalnih oblikah, kot so amorfni prah in v steklasti obliki (kot steklo). V šesterokotni kristalni obliki se vsak od fosforjevih atomov najde v točkah tetraedrona.
Nomenklatura
- Fosforjev oksid (v)
- Fosfor pentoksid
- Difosfak pentoksid
Vam lahko služi: topilo: koncept, vrste in primeri- Fosforni pentoksid
- Fosforni anhidrid
- Razpad tetrafosforja
Lastnosti
Fizično stanje
Kristalno bela trdna trdna snov. Najpogostejša oblika je šesterokotna kristala.
Molekularna teža
283,89 g/mol
Tališče
562 ° C
Temperatura sublimacije
360 ° C do 1 tlačna atmosfera. To pomeni, da pri tej temperaturi prehaja iz plinske trdne snovi, ne da bi šli skozi tekoče stanje.
Gostota
2,30 g/cm3
Topnost
Zelo topno v vodi. Žveplova kislina topna. Netopna v acetonu in amonijaku.
Kemične lastnosti
Fosforjev oksid (v) absorbira in reagira z zrakom iz zraka z ekstremno hitro tvorbo fosforjeve kisline H3Po4. Ta reakcija je eksotermična, kar pomeni, da se toplota proizvaja med istim.
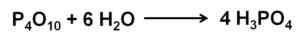 Reakcija fosforja (V) z vodo, da tvori fosforno kislino H3Po4. Avtor: Marilú Stea.
Reakcija fosforja (V) z vodo, da tvori fosforno kislino H3Po4. Avtor: Marilú Stea. Reakcija p4Tudi10 z vodo vodi do nastanka mešanice fosfornih kislin, katerih sestava je odvisna od količine vode in pogojev.
Reakcija z alkoholi vodi do nastanka fosforne kisline ali polimerne kisline, odvisno od eksperimentalnih pogojev.
Str4Tudi10 + 6 ROH → 2 (RO)2Po.Oh + 2 ro.PO (OH)2
Z osnovnimi oksidi tvorijo trdne fosfate.
Je jedko. Lahko nevarno reagira s mravljično kislino in anorganskimi osnovami, kot so natrijev hidroksid (NaOH), kalcijev oksid (CAO) ali natrijev karbonat NA2Co3.
Če vlijemo raztopino HClO perlovoka kisline4 in chcl kloroform3 V fosforjevem oksidu (v) P4Tudi10 Pride do nasilne eksplozije.
Druge lastnosti
Ni vnetljivo. Ne naklonjena zgorevanju. Vendar je njegova vodna reakcija tako nasilna in eksotermična, da lahko pride do požarnega tveganja.
Pridobivanje
Pripravimo ga z neposredno oksidacijo fosforja v suhem zračnem toku. Fosfor, ko je prekomerni stik s kisikom oksidiran, ki tvori fosforjev oksid (V).
Str4 + 5 o2 → P4Tudi10
Prisotnost v naravi
Fosforjev oksid (V) najdemo v mineralih, kot so ilmenit, rutilo in circón.
Vam lahko služi: kakšne so anorganske kemične funkcije?Ilmenit je mineral, ki vsebuje železo in titan in ima včasih fosforjev (V) oksid v koncentracijah, ki se med 0,04 in 0,33% gibljejo po teži. Rutilo je mineral iz titanovega oksida in lahko vsebuje približno 0,02% s težo P2Tudi5.
Circón pesek (mineral cirkonijevega elementa) ima fosfor (V) oksid pri 0,05-0,39% glede na težo.
Prijave
Kot dehidrirajoči in sekanski agent
Zaradi svoje velike avidnosti za vodo je eno najbolj znanih in zelo učinkovitih dehidracijskih sredstev pri temperaturah, manjših od 100 ° C.
Lahko izvleče vodo iz snovi, za katere velja, da dehidrirajoča sredstva. Na primer, lahko odstranite vodo iz žveplove kisline h2SW4 da je tako3 in dušikova kislina hno3 Spreminjanje v n2Tudi5.
 Dehidracija žveplove kisline zaradi fosforjevega oksida (V). Avtor: Marilú Stea.
Dehidracija žveplove kisline zaradi fosforjevega oksida (V). Avtor: Marilú Stea. V bistvu lahko posuši vse te tekočine in pline, s katerimi ne reagira, zato omogoča odstranjevanje sledi vlage iz vakuumskih sistemov.
V reakcijah organske kemije
Fosforjev oksid (v) služi za zapiranje organskih sestavljenih obročev in drugih kondenzacijskih reakcij.
Omogoča sterificiranje organskih kislin z možnostjo razlikovanja med primarnimi alifatskimi karboksilnimi kislinami (gazirana veriga brez obročev s skupino -COOH na enem koncu) in aromatičnimi kislinami (skupina -Hoh, povezana z benzenskim obročem), saj slednja ne reagira.
Služi tudi za odpravo molekule H2Ali od amidas r (c = o) nh2 In to jih naredi nitriles r-cn. Poleg tega katalizirajte ali pospešuje oksigenacijo, dehidrogenacijo in polimerizacijo bitumenskih reakcij.
 P4Tudi10 Široko se uporablja v laboratorijih za organsko kemijo. Avtor: JDN2001CN0. Vir: Pixabay.
P4Tudi10 Široko se uporablja v laboratorijih za organsko kemijo. Avtor: JDN2001CN0. Vir: Pixabay. Pri rafiniranju goriva
Od tridesetih let prejšnjega stoletja dvajsetega stoletja so nekatere študije pokazale, da fosfor (V) oksid izvaja tok za rafiniranje plina in poveča svoj oktana.
Rafiniranje dejanja P4Tudi10 To je predvsem posledica kondenzacijskih reakcij (zveza različnih molekul) in ne zaradi polimerizacije (vezava enakih molekul).
Vam lahko služi: natrijev acetat: struktura, lastnosti, sinteza, uporabaP4Tudi10 Pospeši neposredne alomatske ogljikovodike z olefinskimi ogljikovodiki, pretvorbo olefina v nafthens in delno polimerizacijo. Alkilacijska reakcija poveča oktansko število bencina.
Na ta način dobimo visoko kakovostni rafinirani bencin.
 Nekatere naftne derivate lahko izboljšamo z delovanjem P4Tudi10 V svojih molekulah. Avtor: drpeperscott230. Vir: Pixabay.
Nekatere naftne derivate lahko izboljšamo z delovanjem P4Tudi10 V svojih molekulah. Avtor: drpeperscott230. Vir: Pixabay. V različnih aplikacijah
Fosforjev oksid (v) služi:
- Pripravite fosforno kislino h3Po4
- Pridobite estre akrilata in površinsko aktivne snovi
- Pripravite fosfatne estre, ki se uporabljajo kot zaviralci plamena, topila in razredči
- Pretvorba fosforja triklorida v fosforni oksiklorid
- Laboratorijski reagent
- Izdelajte posebna očala za vakuumske cevi
- Povečajte tališče asfalta
- Služi kot standardna molekula pri določanju fosforja ali fosfatov v fosfatskih kamninah, gnojilih in portlandskem cementu v obliki P2Tudi5
- Izboljšajte povezave med nekaterimi polimeri in slonovino, ki jo imajo zobje
 Nekatera posebna očala, kot so vakuumske cevi, morajo uporabiti P4Tudi10 med izdelavo. Tvezymer [javna domena]. Vir: Wikimedia Commons.
Nekatera posebna očala, kot so vakuumske cevi, morajo uporabiti P4Tudi10 med izdelavo. Tvezymer [javna domena]. Vir: Wikimedia Commons. Tveganja
Fosforjev oksid (V) je treba vzdrževati v zaprtih posodah in na svežih, suhih in dobro prezračenih mestih.
To je, da prepreči, da se ne obrne na vodo, saj lahko z njo silovito reagira in ustvari zelo toploto, do točke, ko sežgajo bližnje materiale, ki so vnetljivi.
Prah fosforja oksida (v) je dražilni oči in dihal in jedko za kožo. Lahko povzroči opekline v očeh. Z zaužitjem povzročajo usodne notranje opekline.
Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Fosforni anhidrid. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Nayler, str. (2001). Bitumens: spremenjeno. Kemična sprememba. V enciklopediji materialov: znanost in tehnologija. Okrevano od Scientirect.com.
- Malishev, b.W. (1936). Fosfor pentoksid kot refinirajoče sredstvo za bencin. Industrijska in inženirska kemija 1936, 28, 2, 190-193. Okrevani iz lokalov.Acs.org.
- Epps, jr. In.Do. (1950). Fotometrična določitev razpoložljivega fosforjevega pentoksida v plodnostih. Analitična kemija 1950, 22, 8, 1062-1063. Okrevani iz lokalov.Acs.org.
- Banerjee, a. et al. (1983). Uporaba fosforjevega pentoksida: esterifikacija organskih kislin. J. Org. Kem. 1983, 48, 3108-3109. Okrevani iz lokalov.Acs.org.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Kirk-Othmer (1994). Enciklopedija kemijske tehnologije. Četrta izdaja. John Wiley & Sons.
- Ogliari, f.Do. et al. (2008). Sinteza fosfatnih monomerov in vezanje na dentin: metode esterifikacije in uporaba fosforjevega pentoksida. Časopis za zobozdravstvo, letnik 36, številka 3, marec 2008, strani 171-177. Okrevano od Scientirect.com.
- « Struktura aluminija acetata (AL (CH3CO) 3), lastnosti, uporabe
- Zapis je razvil, kar je, primeri in vaje »

