Struktura aluminija acetata (AL (CH3CO) 3), lastnosti, uporabe
- 4429
- 616
- Ignacio Barrows
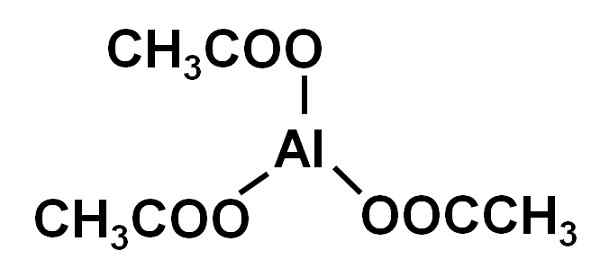
On Aluminijast acetat Gre za organsko spojino, ki jo tvori aluminijasti ion3+ in tri acetatne ione Cho3COO-. Njegova kemična formula je Al (CHO3COO)3. Znan je tudi kot aluminijasti triacetat. Je rahlo higroskopska in topna vodna trdna snov v vodi.
Za pridobitev te spojine je treba uporabiti popolnoma brezvodne pogoje, to je brez vode, sicer se aluminijast diaceat pri (OH) (CH) ponavadi tvori3COO)2.
 Aluminijev triacetat AL (Ch3COO)3. Avtor: Marilú Stea.
Aluminijev triacetat AL (Ch3COO)3. Avtor: Marilú Stea. Raztopine aluminijevega acetata imajo protibakterijske in protiglivične lastnosti, zato so jih od devetnajstega stoletja uporabljali za zdravljenje okužb, zlasti ušes.
Najbolj znana je rešitev Burow, ki jo je zasnoval nemški zdravnik. Vendar je njegova uporaba včasih privedla do poškodbe srednjega ušesa.
Ta rešitev se uporablja tudi za zdravljenje težav s kožo, kot so srbenje in izbruhi. Uporablja se celo kot sončna opeklina.
Aluminijev acetat in njegovi derivati se uporabljajo za pridobivanje zelo majhnih struktur ali delcev glinice do2Tudi3. Te strukture ali nanodelci so lahko v obliki listov, cvetov ali nanocevk.
[TOC]
Struktura
Aluminijast triaceat tvori aluminijasti kation3+ in tri acetatne anione Cho3COO-. To je aluminijasta sol ocetne kisline CH3COOH.
Aluminij je povezan z acetatnimi anioni skozi kisik teh. Z drugimi besedami, povezan je s tremi kisik. Ti sindikati so ionski.
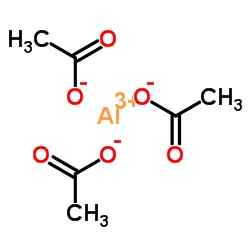 Ionska struktura aluminijevega acetata. N4tr!UMBR [CC BY-S (https: // CreativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons.
Ionska struktura aluminijevega acetata. N4tr!UMBR [CC BY-S (https: // CreativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons. Nomenklatura
- Aluminijast acetat
- Aluminijast triacetat
- Aluminijev etanoat
- Rešitev Burow (angleški prevod Rešitev Burow): Gre za aluminijasto acetatno raztopino.
Lastnosti
Fizično stanje
Bela trdna.
Molekularna teža
204,11 g/mol
Topnost
Topno v vodi.
Kemične lastnosti
V vodni raztopini se aluminijast triaceat raztopi in ponavadi tvori (OH) diacetat (CH)3COO) in včasih monoacetat pri (OH)2(Pogl3COO). Vse je odvisno od pH in količine ocetne kisline3COOH prisoten v rešitvi.
Vam lahko služi: površinska napetost: vzroki, primeri, aplikacije in poskusiAl (pogl3COO)3 + H2Ali ⇔ al (oh) (cho3COO)2 + Pogl3COOH
Al (pogl3COO)3 + 2 h2Ali ⇔ al (oh)2(Pogl3Coo) + 2 ch3COOH
Druge lastnosti
Aluminijev acetat je rahlo higroskopski, to je, da nagiba k absorpciji zračne vode.
Pridobivanje
Aluminijev acetat se prednostno dobi v strogo brezvodnih pogojih, torej v popolni odsotnosti vode. To vključuje tudi odsotnost zraka, saj lahko to vsebuje vlago.
Mešanica ledene ocetne kisline CH segreva3COOH in ocetni anhidrid (ch3Co)2Ali v takšnih pogojih, ki omogočajo odpravo vse sedanje vode. V to vročo mešanico dodamo aluminijev klorid alcl3 Ashidro trdna (brez vode).
Bela trdna snov (ch3COO)3.
Alcl3 + 3 pogl3Cooh → al (ch3COO)3 + 3 HCl
Skupna odsotnost vode je pomembna, da se izognete tvorbi aluminijevih monoacetatnih soli pri (OH)2(Pogl3COO) in aluminijev diacetat pri (OH) (CHO3COO)2.
Dobimo ga lahko tudi z reakcijo aluminijevega hidroksida na (OH)3 in ocetna kislina ch3COOH.
Uporaba v medicini
Ušesne okužbe
Aluminijev acetat se uporablja že od devetnajstega stoletja za zdravljenje otitisa, ki je vnetja zunanjega ali srednjega ušesa, ki ga običajno spremlja okužba. Njegova uporaba je posledica njegovega protibakterijskega in protiglivičnega učinka.
Uporabljali so ga v obliki 13%aluminijeve raztopine acetata, ki jo je prvotno zasnoval nemški zdravnik Karl August von Burow, zato se imenuje Burow Solution.
Ugotovljeno je bilo, da zavira rast mikroorganizmov, ki jih običajno najdemo pri srednjem ali zunanjem otisu, kot je na primer Pseudomonas aeruginosa, on zlati stafilokok in Proteus mirabilis.
 Ušesne okužbe se že vrsto let zdravijo z aluminijastim acetatom. Avtor: Ulrike Mai. Vir: Pixabay.
Ušesne okužbe se že vrsto let zdravijo z aluminijastim acetatom. Avtor: Ulrike Mai. Vir: Pixabay. Vendar obstajajo tisti, ki poročajo, da so te rešitve lahko škodljive za uho. Nekatere študije pri živalih raziskujejo njihove strupene učinke za uho, vendar so poročale o nasprotujočih si rezultatih.
Lahko vam služi: cinkov hidroksid (Zn (OH) 2)Nekateri raziskovalci priporočajo, da aluminijevega acetata ne uporabljajo, ko je perforirana membrana ušesa, saj je bilo opaziti, da ima vnetni učinek na srednje uho.
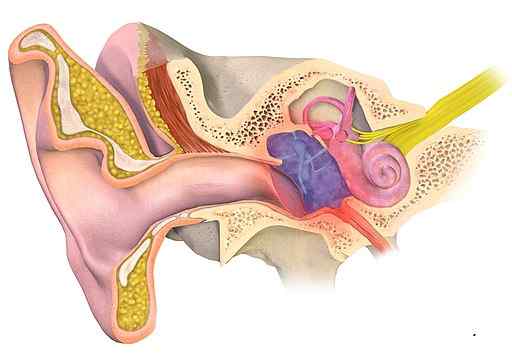 Ni priročno zdraviti otitis media (modrikasto območje na sliki) z aluminijem acetatom. Bruceblaus [cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons.
Ni priročno zdraviti otitis media (modrikasto območje na sliki) z aluminijem acetatom. Bruceblaus [cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons. Kožne bolezni
Raztopina Burow se uporablja kot antiseptična, adstrigentna in kot lokalna rešitev za zdravljenje hudih izbruhov, dermatitisa, vnetja, srbenja, gorenja in sončnih opeklin. Izvaja pomirjujoč in zmanjšan učinek draženja.
 Včasih lahko sončne opekline zdravimo z raztopino aluminijevega acetata. Avtor: Tumisu. Vir: Pixabay.
Včasih lahko sončne opekline zdravimo z raztopino aluminijevega acetata. Avtor: Tumisu. Vir: Pixabay. Druge uporabe
Aluminijasti triaceat in njegovi derivati se uporabljajo za številne kvalitativne in kvantitativne kemijske poskuse.
Derivat aluminijevega triacetata, diacetat pri (OH) (CH3COO)2 Imenuje se tudi aluminijev hidroksid acetat, uporablja se kot predhodnik za pridobivanje nanostruktur gama-alumine (γ-Al2Tudi3).
V tem primeru predhodnik pomeni, da se iz aluminijevega diacetata (dobljeno na določen način) pripravijo γ-al nanostrukture2Tudi3, In to dosežemo s segrevanjem pri zelo visokih temperaturah.
Nanostrukture so zelo majhni delci, ki jih je mogoče opaziti le s posebnimi mikroskopi, kot so elektronski mikroskopi. Z aluminijevim acetatom kot predhodnikom so bile pridobljene nanostrukture γ-to2Tudi3 Podobno kot listi, rože, vlakna in celo nanocevke.
 Alumina nanofribo lahko dobimo z uporabo aluminijevega acetatnega derivata. Aleksei tr [cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons.
Alumina nanofribo lahko dobimo z uporabo aluminijevega acetatnega derivata. Aleksei tr [cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons. Ukinjena uporaba
Na začetku 20. stoletja je bil aluminijev acetat uporabljen kot konzervans za hrano, kot so konzervirane klobase.
Aluminijasto raztopino acetata smo pripravili z mešanjem aluminijevega sulfata2(SW4)3, Caco kalcijev karbonat3, Ocetna kislina Ch3Cooh in agua h2Ali in dodano v hrano.
Ko ta rešitev pride v stik z mesom, se aluminij pritrdi v njene sestavine v obliki spojine, ki je netopna v vreli vodi, vendar se v želodčnih sokovih raztopi za približno 80%.
Lahko vam služi: bromozna kislina (Hbro2): fizikalne in kemijske lastnosti in uporabeŽe leta 1904 je bilo znano, da aluminijeve soli retarda prebave, tako v želodcu kot v črevesju. Zato je nekončasna praksa dodajanje aluminijastih acetatnih rešitev za konzervirano hrano.
 V preteklosti je bil aluminijev acetat uporabljen kot konzervirani konzervirni konzerviran. Trenutno je znano, da je škodljiv in se zanj ne uporablja več. Avtor: Changglc. Vir: Wikimedia Commons.
V preteklosti je bil aluminijev acetat uporabljen kot konzervirani konzervirni konzerviran. Trenutno je znano, da je škodljiv in se zanj ne uporablja več. Avtor: Changglc. Vir: Wikimedia Commons. Škodljivi učinki
Ker obstajajo študije, ki poročajo, da je lahko aluminijev acetat strupen, so bili izvedeni testi, v katerih je bil aluminijev acetat injiciran v laboratorijske miši.
Rezultati kažejo, da ta spojina povzroči poškodbe hrbtenice teh živali, pa tudi poškodbe kromosomov in sperme živali. Z drugimi besedami, je genotoksična.
To opozarja na morebitne nevarnosti za zdravje, ki bi lahko povzročile prekomerno izpostavljenost aluminijevemu acetatu, in na skrb, ki jo je treba sprejeti med uporabo.
Reference
- Mac-kay chace in. (1904). Uporaba osnovnega aluminijevega acetata kot konzervans v klobasi. Journe of American Chemical Society 1904, 26, 6: 662-665. Okrevani iz lokalov.Acs.org.
- Kapuca, g.C. in ihde, a.J. (1950). Aluminijasti acetati in propionati - priprava in sestava. Journal of American Chemical Society 1950, 72, 5: 2094-2095. Okrevani iz lokalov.Acs.org.
- Pitaro, j. et al. (2013). Ototoksičnost aluminijevega acetata/benzenethonijevega klorida otic. Laringoskop, 2013; 123 (10): 2521–5. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Thorp, m.Do. et al. (2000). Rešitev Burow pri zdravljenju aktivnega kroničnega otitis medija: Določitev učinkovitega redčenja. The Journal of Laryngology & Otology, junij 2000, Vol. 114, str.432-436. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- D'Ouza, g.Str. et al. (2014). Ocena genotoksije študije ahetat v kostnem mozgu, moških zarodnih celicah in fetalnih jetrnih celic švicarskih miši albino. Mutacijske raziskave 766 (2014) 16-22. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Bazalno in. et al. (2015). Učinki lokalnih raztopin Burow's in Castellani na sluznico srednjega ušesa podgan. J. Int Adv Otol 2015; 11 (3): 253–6. Okrevana od naprednetotologije.org.
- Ali.S. Nacionalna knjižnica medicine. (2019). Stilling acetat. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Buttaravoli, str. In Leffler, s.M. (2012). Sončne opekline. Kaj storiti. V manjših nujnih primerih (tretja izdaja). Okrevano od Scientirect.com.
- Thompson, e. in kalus, do. (2017). Acte kožne reakcije in bakterijske okužbe. Zdravljenje. V priročniku za potovanja in tropske medicine (Peta izdaja). Okrevano od Scientirect.com.
- Kim, t. et al. (2010). Morfologija, ki jo je mogoče nadzorovati, sinteza gama-alumina. Crystal Growth & Design, vol.10, ne. 7, 2010, str.2928-2933. Okrevani iz lokalov.Acs.org.
- Rajala, J.W. et al. (2015). Core-Shell Electrospun Hollow Aluminium Oxid Keramic Vlakna. Vlakna 2015, 3, 450-462. MDPI se je okreval.com.
- « Navedene komponente geografskega prostora in kako se nanašajo
- Struktura fosforja oksida (v), lastnosti, pridobivanje, uporaba, tveganja »

