Lastnosti klora oksida (v), struktura, uporabe

- 799
- 27
- Raymond Moen
On Klorin oksid (V) Je zelo nestabilna anorganska spojina, katere kemična formula je Cl2Tudi5. Je eden izmed številnih klorovih oksidov, za katere je značilno, da so molekularne ali celo radikalne vrste.
Cl2Tudi5 Življenje je našel le na papirju in teoretičnih izračunih; Vendar njegov obstoj ni bil izključen in verjetno je, da jih je mogoče označiti (z naprednimi spektroskopijskimi tehnikami)). Zaradi splošnih konceptov kemije je mogoče napovedati tega oksida, je, da gre za anhidrid klorinske kisline, hclo3.
 Molekula Cl2O5. Vir: Jynto [CC0].
Molekula Cl2O5. Vir: Jynto [CC0]. Hipotetična molekula klorovega oksida (V) je prikazana zgoraj (V). Upoštevajte, da ker gre za molekulo, prisotnost CL+5; Še manj, ko mora imeti tako polarizirajočo moč, da sili kisik, kovalentno povezuje.
Kot vsaka nestabilna spojina, tudi on sprošča energijo za razgradnjo v bolj stabilne izdelke; postopek, ki je v mnogih primerih eksploziven. Ko je Cl2Tudi5 Razbije svobodo2 jaz2. Teoretično je, da v vodi, odvisno od izomera CL2Tudi5, Lahko se tvori več klorovih oksoacidov.
[TOC]
Lastnosti
Molarna masa Cl2Tudi5 je 150.9030 g/mol. Iz te mase in njegove hipotetične molekule je mogoče domnevati, da bi bila, če bi jo lahko izolirali, verjetno mastna tekočina; Seveda ga primerjamo s fizičnim videzom CL2Tudi7.
Čeprav ga ni mogoče izolirati ali označiti, je ta klorin oksid kisel, kovalenten in mora imeti tudi majhen dipolski trenutek. Njegova kislost je razumljiva, če analiziramo kemično enačbo njegove hidrolize:
Vam lahko služi: Amagat zakon: Pojasnilo, primeri, vajeCl2Tudi5 + H2Ali 2HClo3
Biti hclo3 Klorova kislina. Obrvna reakcija bi povzročila, da je kislina lahko dehidrirana:
2HCLO3 => Cl2Tudi5 + H2Tudi
Na drugi strani, ko je Cl2Tudi5 Takoj, ko se zgodi, se razpade:
2Cl2Tudi5 => 4Clo2 + Tudi2
Je torej posredniška vrsta namesto oksida, ki pravilno govori. Njegova razgradnja mora biti tako hitra (če upoštevamo, da je CL celo oblikovan2Tudi5), ki je ne bi bilo mogoče zaznati s trenutnimi tehnikami instrumentalne analize.
Struktura klora oksida (V)
Molekula
Na zgornji sliki je bila prikazana struktura hipotetične molekule CL2Tudi5 Z modelom sfer in palic. Rdeče kroglice predstavljajo atome kisika in zelene do klora. Vsak klor ima trigonalno piramidno okolje, zato mora biti njegova hibridizacija SP3.
Tako molekula CL2Tudi5 Lahko ga vidimo kot dve trigonalni piramidi, ki jih povezuje kisik. Če pa ga skrbno opazimo, piramida vodi njegove kisikove atome navzdol, drugo pa iz ravnine (v smeri bralca).
Od tu se domneva, da v povezavi obstajajo rotacije oz2Cl-o-cl2, zaradi česar je molekula razmeroma dinamična. Upoštevajte, da formula oz2Cloclo2 To je način, kako predstavljati strukturo CL2Tudi5.
Lewisova struktura
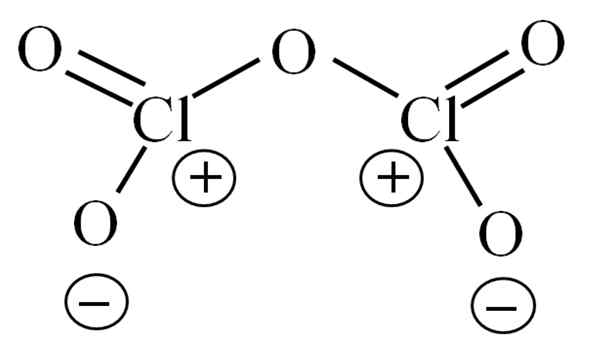 Lewisova struktura za hipotetični CL2O5. Vir: Gabriel Bolívar.
Lewisova struktura za hipotetični CL2O5. Vir: Gabriel Bolívar. Do zdaj sama molekula ni dovolila dešifriranja, kakšna je njegova nestabilnost. Za osvetlitev tega vprašanja se uporablja njegova struktura Lewis, predstavljena zgoraj. Upoštevajte, da je mogoče napačno misliti, da je struktura ravna, toda v sprednjem podsekciji je bilo razjasnjeno, da ni tako.
Vam lahko služi: natrijev azid (nan3): struktura, lastnosti, uporabe, tveganjaZakaj imata oba atoma klora pozitivne formalne obremenitve? Ker ima klor par brez elektronov, ki ga je mogoče preveriti, ko je uporabljena teorija povezav Valencia (česar zaradi poenostavitve tukaj ne bo narejena). Tako je njegova formalna obremenitev:
CF = 7 - (4 + 2) = 1
In kaj ima to veze z vašo nestabilnostjo? No, klor je znatno elektronegativen, zato je slab nosilci pozitivnih formalnih obremenitev. To se vrne v CL2Tudi5 Izjemno kisla vrsta, saj mora pridobiti elektrone za zagotavljanje elektronskega povpraševanja obeh klorosov.
Z BR se zgodi nasprotno2Tudi5 in i2Tudi5, oksidi, ki obstajajo v normalnih pogojih. To je zato, ker sta tako bromin kot jod manj elektronegativna kot klor; In zato bolje podpirajo pozitivno formalno obremenitev.
Izomeri in njihova hidroliza
Zaenkrat je celotna razlaga padla na enega od dveh izomerov CL2Tudi5: O2Cloclo2. Kar je drugo? O3Cloclo. V tem izomeru klorosi nimajo pozitivnih formalnih obremenitev in bi morali biti zato stabilnejša molekula. Vendar tako oz2Cloclo2 kot o3Cloclo naj trpi reakcije hidrolize:
Tudi2Cl-o-cl2 + H2O => 22Cl-OH (ki niso nič drugega kot HClo3)
Tudi3CL-O-CLO + H2O => o3CL-OH (HClO4) + Ho-clo (hclo2)
Upoštevajte, da je mogoče oblikovati do tri klor oksocide: HClo3, Hclo4 In hclo2
Nomenklatura
Njeno ime „klor oksid (v)“ ustreza dodeljenemu v skladu z nomenklaturo zalog. Cl2Tudi5 Ima lahko tudi še dve imeni: dikloro in kloriranje anhidrid pentaoksid, ki ga dodelijo sistematični in tradicionalni nomenklaturi.
Vam lahko služi: Titanium: Zgodovina, struktura, lastnosti, reakcije, uporabePrijave
Več kot motivirati računalniški študij, CL2Tudi5 Manjka bo uporabe, dokler ga ne bodo odkrili, izolirali, označili, shranjeni in pokazali, da ne eksplodira na najmanjši stik.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Sandra Luján Quiroga in Luis José Perissinotti. (2011). Klor oksoacidi in struktura diklorovih oksidov. Kem. Vzgojitelj, Vol. 16.
- Kemična formulacija. (2019). Klorin oksid (V). Obnovi se od: quimica formulacije.com
- Linus Pauling. (1988). Splošna kemija. Dover Publications, Inc., New York.
- Richard c. Ropp. (2013). Enciklopedija alkalnih zemeljskih spojin. Elsevier.

