Struktura železovega hidroksida (II), lastnosti, uporabe
- 3415
- 650
- Roman Schamberger
On železni hidroksid (ii), Imenuje se tudi železov hidroksid, je anorganska spojina vere kemijske formule (OH)2. Če je njegova čistost velika, je njegova trdna snov sestavljena samo iz verodostojnih ionov2+ in oh- V razmerju 2: 1; Vendar lahko molekule vode in različne ionske vrste vsebujejo in spreminjajo položaj.
Predstavlja "zmanjšano" obliko znane rje, rdečkaste površine, sestavljene iz verodostojnih ionov3+; Medtem ko v zelenkasti rje prevladuje vera2+, Zraven OH- in še ena količina anionov: co32-, SW42-, Ne3- in haluros (f-, Cl-,…), Na primer. Rezultat, čeprav je osnova te zelene rje vera (OH)2, je, da dobimo različne trdne snovi.
 Zeleni oksid na železni površini: izvorni material te vrste hidroksida. Vir: Pixabay.
Zeleni oksid na železni površini: izvorni material te vrste hidroksida. Vir: Pixabay. V vsakdanjem življenju lahko ta hidroksid razmišljamo na skupnih mestih. Na primer, zgornja slika ima pokrito površino zelene rje (ne patina). Obstaja vera (oh)2, vendar jih spremljajo številni ioni iz morskih valov.
Kemično gledano so lastnosti in uporabe tega gradiva odvisne od vere2+ in njegove nagnjenosti k oksidaciji, da se spremeni v vero3+. Gre za reducirajoče sredstvo, ki v osnovnih pogojih hitro reagira s kisikom. Zato ga je treba uporabiti v inertni atmosferi in kislinskih raztopinah.
[TOC]
Struktura železovega hidroksida (II)
Povezave
Glede na samo vero (OH)2 Čisto, ni nič več vere2+ in oh-.
Interakcije med njimi morajo biti teoretično ionske narave; Vsaka vera vera2+ Privabi dva aniona oh-, katerih ne -usmerjene znamenitosti na koncu vzpostavijo strukturni in ponavljajoči se vrstni red, ki definira kristal; To posledično povzroča zeleni rjavi prah.
Lahko vam služi: cinkov hidroksid (Zn (OH) 2)Težava je v tem, da obstaja določen kovalentni značaj med obema ionima, zato ionske povezave Fe-OH ni mogoče prezreti. Glede na delno ionsko povezavo Fe-OH je mogoče razumeti, da so združeni v nekakšno polimerno plast.
Dvojne plasti hidroksida
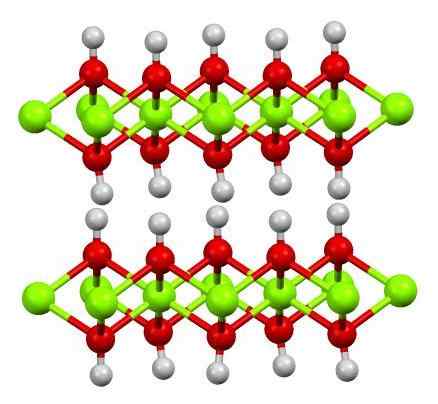
 Struktura vere (OH) 2. Vir: Smokefoot [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]
Struktura vere (OH) 2. Vir: Smokefoot [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] Zgoraj je prikazana struktura čistega železovega hidroksida z modelom kroglic in palic. Fe kationi2+ Zastopajo jih Chillón zelene krogle, medtem ko OH anioni- Za rdeče in bele sfere. Upoštevajte, kako so usklajeni vera2+ Zahvaljujoč interakcijam (ionsko-kovalentnim) z OH-.
Zakaj so ta struktura dvojna plast hidroksidov? Sama slika ponuja odgovor: Obstajata dve vrsti ali plasti OH- Za vsako vero2+; to pomeni, da je delež 2: 1 vere (OH) vzdrževan2 omenjeno na začetku.
Strukturne enote za vero (OH)2 Nato so ti sendviči, kjer so plasti OH- Prišli bi, da bi zastopali hlebce; negativno naložen kruh in ki zato ne popravi osupljivega rjavega kristala.
Toda na drugi strani se atomi H tudi poravnajo in zamrjejo med seboj. Če se spominjajo koncepta polarnosti in elektronegativnosti, imajo ti vodiki rahlo pozitivno delno obremenitev, Δ+; ki imajo, čeprav šibke, lahko pozitivno območje, kjer so nameščeni drugi anioni ali molekule.
Hidrati
Ko vera (oh)2 Raztopi se v vodi, njegove molekule se usklajuje s kovinskim središčem vere2+ Oblikovati kompleksno acu: [vera (h2Da)4(OH)2]. Ta kompleks ima oktaedrsko geometrijo za šest ligandov: štiri molekule vode in dve OH-. Vendar je v železovem hidroksidu panorama nekoliko drugačna.
Vam lahko služi: zakon o ohranjanju snoviV hidratu hipotetična formula Fe (OH)2· NH2Ali pa so molekule vode nameščene točno med dvema plastma hidroksida; to pomeni, da komunicirajo prek dipol-ionskih sil z belimi vodiki ali kroglami. Kot da bi bili zgrajeni dve tekmi z ohfeohom in je bila prepletena voda, da bi jih združila: Ohfeoh (H2O) ohfeah.
Molekule vode so zelo dinamične, kar preprečuje, da bi hidratni delci pridobili velike velikosti in posledično tvorijo trdno koloidno ali žele.
Zelena in rdeča rje
V hidratih imajo hidroksidne plasti prepletene molekule vode; Vendar imajo lahko druge anione (že omenjene), kar povzroča široko paleto zelenih herrblov. Prav tako lahko "ujamejo" molekule tako velike kot DNK ali zdravila.
Ne samo, da so prisotni vere2+, pa tudi vera3+, produkt notranje oksidacije, ki jo povzroča prepleteni kisik. Vidno bi bilo opaziti, da zelena rje (u oksid) začne postajati rdečkasta, ko se koncentracija vere povečuje3+.
Lastnosti
 Epruveta s železovskim hidroksidom v vodi. Vir: Chemical Interest [javna domena]
Epruveta s železovskim hidroksidom v vodi. Vir: Chemical Interest [javna domena] Vera (OH) je prikazana zgoraj2 oborino v epruveti. Ker je v obilni vodi, mora biti kompleksni ACU prevladoval nad novo omenjeno strukturo. Upoštevajte, da je površina videti kot oranžna barva, kar je posledica oksidacije vere2+ do vere3+ za kisik zraka; To pomeni, da je ta hidroksid reducirajoče sredstvo:
Vera2+ Vera3+ + in-
Fizični videz te spojine v njegovem najčistejšem stanju je rjave trdne snovi:
 Čisti železov hidroksid. Vir: Ondřej Mangl [javna domena]
Čisti železov hidroksid. Vir: Ondřej Mangl [javna domena] Ki je lahko, odvisno od stopnje vlažnosti, predstavljeno kot želeno -zeleno trdno. Je precej netopna v vodi (ksp= 8 · 10-16 in topnost = 0,72 g/100 ml pri 25 ° C) in ima molarno maso 89,86 g/mol in gostoto 3,4 g/ml.
Lahko vam služi: 20 vrst kemije in njihova denifikacijaZa to spojino se ne poročajo o vrelišču ali fuzijski točki; Verjetno zaradi dejstva, da pred virom toplote postane dehidriran in se pretvori v železov oksid, grd:
Vera (OH)2 => Grd + h2Tudi
Prijave
Organska kvalitativna analiza
Njegova redukcijska moč se uporablja za določitev prisotnosti nitro spojin, RNO2. Reakcija, za katero se dobi pozitiven test, je predstavljena z naslednjo kemijsko enačbo:
Rno2 + 6FE (OH)2 + 4H2O => rnh2 + 6FE (OH)3
Vera (oh)3 oborine kot trdna snov rjave -relizo, ki potrjuje prisotnost nitro skupine, -no2.
Selenijevi oksoanioni reduktor
Zmanjšana moč vere (OH)2 Uporablja se tudi za zmanjšanje SEO anionov32- (Selenito) in SEO42- (selenat) do elementarnega selena,. Praktično omogoča odstranjevanje takšnih anionov, škodljivih za zdravje, v obliki netopne in lahko odstranljive selenske trdne snovi.
Materiali z dvojnimi plastmi
Njegova čista struktura in zelena rje je vir navdiha za oblikovanje novih materialov mineraloških značilnosti.
Ocenjuje se, da funkcija le -teh omogoča transport določene vrste med njegovimi plastmi, tako da je mogoče njegovo osvoboditev nadzorovati ali zmanjšati na aktivno mesto (tla, celice, kovinsko površino itd.).
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2019). Železo (ii) hidroksid. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2019). Železovi hidroksid. Baza podatkov Pubchem. Cid = 10129897. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Nick Doe. (s.F.). Testi za fenole in nitro skupine. Kemija 211. Pridobljeno od: akademiki.Wellesley.Edu
- Clark Jim. (27. april 2019). Kemija železa. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Kingston Tehnična programska oprema. (2019). Kemija rje. Korozijski zdravniki. Okrevano od: korozijske dotori.org
- Zingaro, Ralph a. et al. (1997). Zmanjšanje oksiselenijevih anionov z železom (II) hidroksidom. Okolje International. 23 (3): 299–304. Doi: 10.1016/S0160-4120 (97) 00032-9

