Kisle baze arrhenius, teorije Bronsted-Lowry, Lewis

- 4139
- 133
- Don Nitzsche
 Graf, ki povezuje tri glavne teorije kislin in baz. Vir: TEM5PSU, CC BY-SA 3.0, prek Wikimedia Commons
Graf, ki povezuje tri glavne teorije kislin in baz. Vir: TEM5PSU, CC BY-SA 3.0, prek Wikimedia Commons Kaj so kisline in osnovne teorije?
Teorije kisline in baze so sklop konceptualnih prispevkov, ki definirajo in razlikujejo kisline in baze, dva konglomerata neizmernih ustreznih snovi na področju kemije.
Njegove korenine izvirajo iz prvih značilnosti, ki jih je izdelal Robert Boyle leta 1661, ki je definiral kisline, kot so kisle in jedke snovi, ki spreminjajo barvo modrega v rdeči vzmetni papir; In baze, kot so milne snovi, ki za razliko od kislin spremenijo barvo rdečega v modri papir.
Antoine Lavoisier je predlagal, da vse kisline vsebujejo kisikove atome, kot je H2SW4 in hno3. Stoletja pozneje leta 1811 je Humphry Davy ugotovil, da veliko kislin dejansko nima atomov kisika, kot so HCL, HF, HBR, ETC.
In tik pred pojavom znane triade za kislinsko bazo (nadrejena slika) je Justig Liebig predlagal, da imajo kisline vodikove atome, ki jih lahko nadomestijo s kovinskimi kationi.
To empirično znanje je služilo kot navdih za trenutne teorije kislin in baz: Arrhenius, Bronsted-Lowry in Lewis. Kot je razvidno iz grafa, je Arrhenijeva teorija najbolj restriktivna ali omejena od vseh, Lewisova pa je najbolj splošna in globalizirana.
Arrenijeva teorija
Njegova teorija, ki jo je leta 1884 predlagal Svante Arrhenius, pravi, da kisline, ko se raztopijo v vodi, proizvajajo ione H3Tudi+ ali h+; Medtem ko se baze pri raztapljanju v vodi, proizvajanju ali sproščanju OH ionov-.
Ioni h3Tudi+ in oh- Združujejo v reverzibilni reakciji, ki povzroča molekule vode:
H3Tudi+ + Oh- ⇌ 2H2Tudi
Vam lahko služi: disulfrinska kislina: kaj je, struktura, lastnosti, uporabeTorej, arrenijeva kislina je tudi tista, ki poveča koncentracijo H ionov3Tudi+, Medtem ko je baza Arrhenius tista, ki povečuje koncentracijo iona OH-.
To pomeni, da arrhenijeva kislina ne sme nujno vsebovati H ionov3Tudi+, In baza Arrhenius ni treba imeti OH ionov- V svoji strukturi.
Primer in omejitve
Razmislite o naslednjih disociacijah:
Hcl (ac) → h+(AC) +Cl-(AC)
NaOH (AC) → NA+(AC) +OH-(AC)
HCl je arrhenijeva kislina, ker ko se raztopi v vodi+, ali bolj pravilno, h ioni3Tudi+. In po drugi strani je Naoh arreniusova baza, ker ko se raztopi v vodi, OH ioni sprošča-. Te snovi se med seboj reagirajo, da proizvajajo sol in vodo:
HCl (AC) + NaOH (AC) → NACl (AC) + H2Tudi
Težava s teorijo Arrenius je v tem, da je omejena le na vodne raztopine, zato velja samo za snovi, ki so topne v vodi. Na primer, MGO je zelo netopen v vodi, vendar je osnovni oksid.
Prav tako si ne more razložiti, kako snovi, kot je NH3 in cao proizvede OH ions- raztopljen v vodi, tudi kadar nimajo ionov oh- V svoji molekularni ali kristalni strukturi (kot je primer NaOH ali KOH).
In ne pojasnjuje, kako je2 lahko sprosti ione h3Tudi+ V vodi, ne da bi imeli atom vodika v svoji molekularni strukturi (kot je to pri HCl ali H2SW4).
Brönsted-Lowry Teorija
Predlog individualno leta 1923 Johannes Bronsted in Thomas Lewry, njihova teorija kislin in baz pravi, da je kislina vse ta snov, ki lahko daje ione h+, in da je osnova namesto tega vsaka snov, ki lahko sprejme te h+. Ta teorija je bolj splošna kot pri Arreniusu in zajema več njegovih omejitev.
Vam lahko služi: molarne rešitve: koncept, priprava, primeriPrimer
Razmislite o enačbi nevtralizacije med H3Tudi+ in oh- Za proizvodnjo dveh molekul vode:
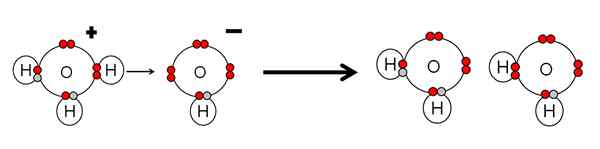 Primer nevtralizacije kisline in vodne baze. Vir: Gabriel Bolívar.
Primer nevtralizacije kisline in vodne baze. Vir: Gabriel Bolívar. Upoštevajte, da h3Tudi+ Naredil h+ ki bodo takoj povezani ali usklajeni z OH- prav -Right. Ko h+ Konča se povezan z enim od parov brez elektronov OH-, Dve nevtralni molekuli vode ostaneta kot proizvodi.
H3Tudi+ Zato gre za Brnsted-nizko kislino za darovanje H+, in oh- To je BRNSTED-nizka osnova za sprejemanje tega h+.
Drug primer reakcije kisline baze je naslednji:
Nh3(g) + hcl (g) → nh4Cl (s)
Po Arreniusovem mnenju te reakcije ni bilo mogoče obravnavati kot kislina baza. NH3 To je baza BRNSTED, ker sprejema HCl H z doniranjem nekaj elektronov, ki se nahajajo na dušikovem atomu; In HCl, logičen, postane Brnsted kislina.
Tako je MGO BRNSTED baza, ker lahko sprejme h+ kislin za preoblikovanje v mg (OH)2.
Lewisova teorija
Teorija Bronsted-Lowry pojasnjuje širok spekter reakcij kisline. Vendar ignorirajte tiste reakcije, kjer h ioni+ in oh- Sploh niso vpleteni, pa tudi večja udeležba prostih elektronov v molekularnih mehanizmih.
Tako je leta 1923 g. N. Lewis je predlagal teorijo o kislini, ki piše naslednje: kislina je vsaka snov, ki lahko sprejme pare elektronov, medtem ko je osnova tista, ki podari te pare elektronov.
Lahko vam služi: DAPI (4 ', 6-diamidino-2-fenilindol): značilnosti, temelj, uporabaNa primer ion h+ To je Lewisova kislina, ker sprejema elektronske pare vseh vrst: iz H2Ali da izvira h3Tudi+, od NH3 Za nastanek NH4+, itd.
Primer in prednosti
Razmislite o drugem primeru v naslednji reakciji:
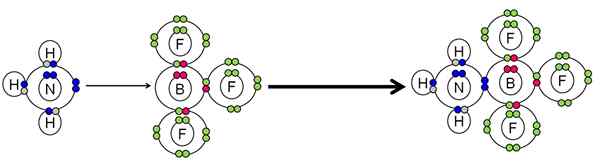 Primer nevtralizacije med kislino in lewisovo bazo. Vir: Gabriel Bolívar.
Primer nevtralizacije med kislino in lewisovo bazo. Vir: Gabriel Bolívar. NH3 Naredila par elektronov (modrega) dušikovega atoma do atoma BF bora3. Zato NH3 To je osnova Lewisa, ker podari par elektronov in BF3 Lewisova kislina je, ker jih sprejme.
Na splošno so kationi in slabi elektroni Lewisove kisline, medtem ko so anioni in vrste, ki so na elektroni, lewis baze.
Ponujene prednosti.
Na primer: h2O ima proste elektrone v kisiku. Če enega od njih podarite ion h+, bo deloval kot lewis baza, saj bo h+ Posledično Lewisova kislina.
Po besedah Bronsted-Lowry, h2Ali pa bi deloval kot osnova, ker natančno sprejema h+ Z donacijo nekaj njihovih brezplačnih elektronov. In končno, h2Ali pa je tudi osnova po Arrenijevi teoriji, ker se koncentracija H ionov zmanjšuje+ v vodnem okolju in posledično povečanje koncentracije OH ionov-.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Clark Jim. (2002). Teorije kislin in baz. Okrevano od: Chemguide.co.Združeno kraljestvo
- Broderick c., Moussa m., & Clark J. (21. avgusta 2020). Pregled kislin in baz. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Wikipedija. (2020). Kislinska reakcija. Pridobljeno iz: v.Wikipedija.org
- Teksaška univerza A&M. (s.F.). Kisline in baze: razvoj kislin in baz. Okrevano od: kem.Tamu.Edu

