Struktura kalijevega bromida (KBR), lastnosti, uporablja
- 1887
- 310
- Raymond Moen
On kalijev bromid To je anorganska sol, katere kemična formula je KBR. Tvori ga elektrostatična zveza bromidnega aniona, Br-, In kalijev kation, k+, v deležu 1: 1; to pomeni, da imamo enako količino BR- od k+ V kristalih KBR.
Kalijev bromid je trdna bela ali kristalna sol, brez vonja, zelo topna v vodi in malo topna v etanolu in etanolu. Uporabljali so ga v zadnjem delu 19. stoletja in večji del dvajsetega stoletja pri zdravljenju epilepsije in kot sedativ.
Do leta 1975 se je še naprej prodala, leto, v katerem se je njegova uporaba zmanjšala zaradi strupenih učinkov, ki jih je povzročil pri bolnikih. Trenutno se še vedno uporablja pri več vrstah živali pri zdravljenju napadov, čeprav ga je od leta 1912 nadomestil natrijev fenobarbital.
Kalijev bromid se uporablja v optičnih študijah, ki ustreza bližnjem infrardečem območju elektromagnetnega spektra. Služi tudi kot material, ki se uporablja na področju fotografije.
[TOC]
Vrsta povezave
Kalijev bromid je binarna sol, produkt kombinacije atoma broma z oksidacijskim stanjem -1, z atomom kalija z oksidacijskim stanjem +1. Zato se vzpostavi električna privlačnost med ionom BR- In k ion+.
Ta vrsta električne ali elektrostatične interakcije je znana kot ionska vez, ki se disociira, ko se kalijev bromid sol raztopi v vodi in sprošča K ione+ in br-.
Te ione razpadejo lastniki vode.
Struktura kalijevega bromida
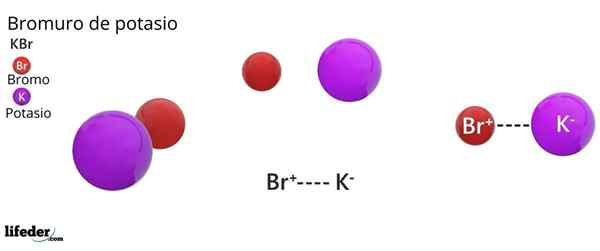
 Kristalna struktura FCC KBR: rjave kroglice ustrezajo BR-, medtem ko vijolične kroglice ustrezajo kationom K+
Kristalna struktura FCC KBR: rjave kroglice ustrezajo BR-, medtem ko vijolične kroglice ustrezajo kationom K+ Kalijev bromid predstavlja kubično kristalno strukturo, osredotočeno na obraz (FCC) Kubični z obrazom), enako tistemu, ki ga opazimo pri natrijevem kloridu.
Vam lahko služi: Faraday ConstantV tej strukturi vsak anion Br- Je povezan ali usklajen s šestimi k kationi+, In po drugi strani+ Ima šest BR- Kot sosedje v kristalnih omrežjih.
Nomenklatura
Kalijev bromid je razvrščen kot halogenid ali alkalni kovinski halogenid. Imena teh soli so zgrajena z odpravo končne črke imena halogena (klor, bromin, jod, fluorin in astato), razen fluorida, in končno črko zamenjava s pripono -Uro. Ime kovine je napisano spodaj brez modifikacije.
Na primer: natrijev klorid, kalijev jodid, kalcijev fluorid itd. Zato se KBR imenuje kalijev bromid ali kalijev bromid (v skladu s tradicionalno nomenklaturo).
Lastnosti kalijevega bromida
 Urani disk z zrnci KBR. Vir: Walkerma prek Wikipedije.
Urani disk z zrnci KBR. Vir: Walkerma prek Wikipedije. Fizični videz
Brezbarvno steklo, kristalna ali bela zrnca.
Vonj
Stranišče
Okus
Pri visoki koncentraciji ima grenki in začinjen okus.
Molarna masa
119.02 g/mol
Gostota
2.74 g/cm3 pri 25 ° C
Tališče
734 ° C
Vrelišče
1435 ° C
Topnost vode
535 g/l a 0 ° C
678 g/l a 25 ° C
1020 g/l a 100 ° C
1 gram soli se raztopi v 1 ml vrele vode, kar kaže, da je v vodi zelo topen.
Topnost v glicerolu
217 g/l
1 gram kalijevega bromida se raztopi v 4.6 ml glicerola.
Topnost etanola
47.6 g/l a 80 ° C.
1 gram kalijevega bromida se raztopi v 250 ml etanola.
Gostota hlapov
7.14 v zračnem razmerju, ki je vzeta kot enota.
Stabilnost
Stabilno, če je shranjeno pod priporočenimi pogoji. Nezdružljivo z oksidacijskimi sredstvi, močnimi kislinami, bromom trifluoridom in bromom.
Razgradnja
Ko se segreva na razgradnje, oddaja škodljive izdelke, kot sta vodikov bromid in kalijev oksid.
Lahko vam služi: Elektronska konfiguracija jedra: konstrukcija, primeriIndeks loma (ND)
1.559
ph
V vodni raztopini proizvede nevtralen pH, približno 7.
točka vžiga
1435 ° C
Raztapljanje in reaktivnost
V vodni raztopini je KBR popolnoma disociiran, da povzroči nevtralno raztopino pH.
Salt je vir bromida, ki ga je mogoče uporabiti za proizvodnjo srebrnega bromida, AGBR, spojina, ki se uporablja pri razvoju fotografij:
Kbr (ac) +agno3 (Ac) → agbr (s) +kno3 (AC)
Tudi KBR je šibko reducirajoč sredstvo, nezdružljivo z živosrebrom in srebrnimi soli. Povzroči silovito reakcijo z bromonskim trifluoridom. Lahko reagira s številnimi soli, alkaloidi in škrobom.
Reagira tudi s kislinami, na primer s koncentrirano žveplovo kislino, sprošča vodikov bromid.
Prijave
Zdravljenje epilepsije in napadov
Antikonvulzivne lastnosti kalijevega bromida je najprej izpostavil sir Charles Locock, na sestanku kraljeve medicine in kirurškega društva leta 1857, ki je spodbujala njegovo uporabo pri zdravljenju epilepsije.
Kalijev bromid je bil uporabljen kot prednostno zdravilo pri zdravljenju epilepsije in kot sedativ do leta 1912, ko je bil objavljen natrijev fenobarbital.
Kljub temu je bilo še naprej uporabljeno kot dopolnilo natrijevega fenobarbitala pri zdravljenju napadov epilepsije.
Leta 1975 je zaradi strupenega značaja FDA U.S. (Uprava za hrano in zdravila) se je odločila, da ne bo priporočila uporabe kalijevega bromida, tako pri ljudeh kot pri živalih. Vendar pa so nekatere države še naprej upravljale.
Kalijev bromid je bil uporabljen kot hipnotični in sedativni pri govedu, konjih, ovcah in prašičih. Uporabljali so ga tudi pri zdravljenju kolik in Tetanije pri konjih ter pri zdravljenju napadov pri psih.
Infrardeča optika
Zaradi prosojnosti kalijevega bromida v različnih valovnih dolžinah med ultravijolično svetlobo in bližnjo infrardečo se uporablja kot sestavni del oken za več elektromagnetnega sevanja, zlasti infrardečega sevanja.
Vam lahko služi: osmolarnostV zvezi s tem se uporablja več tehnik. Eden od njih je sestavljen iz izdelave dveh kristalnih diskov kalijevega bromida, ki postavlja film gradiva, ki ga je treba analizirati v infrardeči v albumih. Študije potekajo v bližnji infrardeči med 780 nm in 3000 nm.
Fotografija
 KBR je bil del materialov, ki so bili uporabljeni za obdelavo prvih fotografij dvajsetega stoletja
KBR je bil del materialov, ki so bili uporabljeni za obdelavo prvih fotografij dvajsetega stoletja Kalijev bromid je imel na primer številne uporabe in aplikacije v fotografiji: Uporabljali so ga za oblikovanje razvijalcev fotografij, v izdelavi fotografskih filmov, kot filmske debeleze in kot barvno belilo v barvi.
Uporablja se pri izboljšanju diferenciacije med izpostavljenimi in izpostavljenimi kristali srebrnih halogenov pri povečanju gostote tiskanja tankih negativ in kot sekundarni halogenid v kombinaciji z jodidi za obdelavo negativnega papirja na papirju.
Uporabljali so ga tudi v kombinaciji z živosrebrnim bikloridom, bakrenim sulfatom ali kalijem ferikurio pri fotografskih belilih. Služil je tudi kot omejitev pri razvijalcih alkalij, ki se uporabljajo za želatinske plošče in razvojne dokumente.
Kemična analiza
KBR se uporablja pri določanju ocene bakra in srebra v polarografski analizi indijskega, kadmija in arzena.
Druge uporabe
Uporablja se v procesih graviranja litografije, pri predelavi olja, v toplotni stabilizaciji najlona, v proizvodnji vlaken in na koncu pri izdelavi posebnih mil.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Dan, r., & Underwood, a. (1986). Kvantitativna analitična kemija (Peti izd.). Pearson Prentice Hall.
- Wikipedija. (2020). Kalijev bromid. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2021). Kalijev bromid. Pubchem Comunund Povzetek za CID 253877. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Emea. (1999). Bromid, kalijeva sol: povzetek poročila. [PDF]. Okreval od: EMA.Evropa.EU
- Sevier b.V. (2020). Kalijev bromid. Znanstveno. Pridobljeno iz: SCINCEDIRECT.com

