Povezava vodikovega mostu
- 5104
- 11
- Adrian Legros
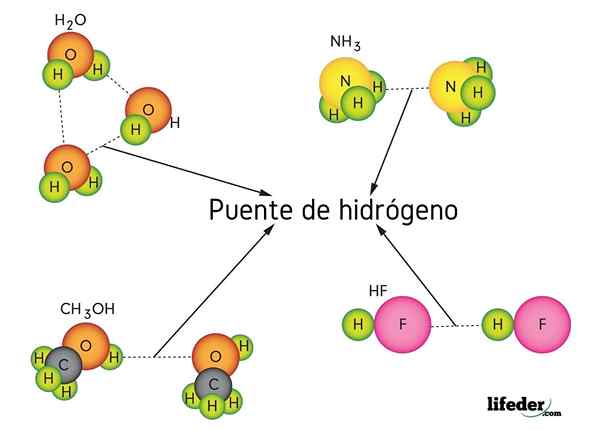
 Vodikov most v vodi (h2O), metanol (cho3OH), vodikov fluorid (HF) in amonijak (NH3)
Vodikov most v vodi (h2O), metanol (cho3OH), vodikov fluorid (HF) in amonijak (NH3) Kaj je povezava vodikovega mostu?
Vez vodikovega mostu je posebna vrsta interakcije dipola-dipolo, ki pripada silam van der Waals, v katerih se vodikov atom pridruži dvema ali več molekula. Ni govora o elektronskem predelu, ampak o predvsem elektrostatičnem pojavu.
Kot že ime pove, vodik deluje kot most, zato mora biti med dvema atomama. Vodik je povezan (H-X) z zelo elektronegativnim atomom (kot so N, O in F) in se približa drugemu elektronegativnemu atomu, vendar iz sosednje molekule. Posledica tega je nastanek vodikovega mostu X ··· H-X.
Upoštevajte, da v reprezentaciji X ··· H-X točke simbolizirajo vodikov most, medtem ko skript predstavlja kovalentno vez med H in X. Kljub temu si oglejmo vodikov most med dvema molekulama vode, kjer je x atom kisika: H2Ali ··· H-OH (spodnja slika).
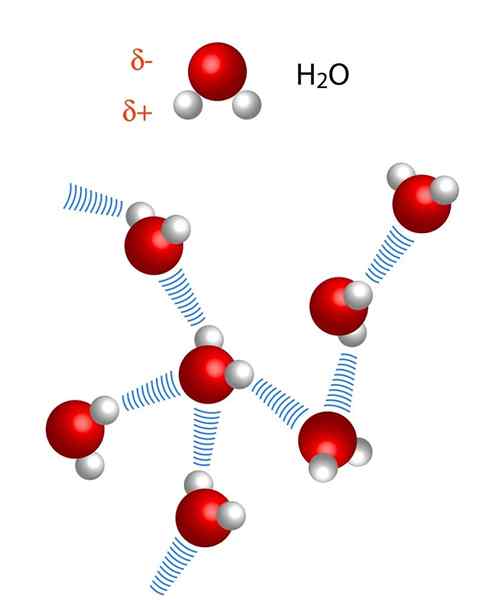
Na zgornji sliki vidimo, da sedem molekul vode ostane skupaj zaradi njihovih vodikovih mostov, ki jih predstavljajo modre črte. Samo vodikov most ni zelo močan, toda ko jih je milijard, dajo zadevo nenormalne in nepričakovane lastnosti.
Značilnosti vodikovega mostu
Kompozicija
Vodikov most je treba resnično predstaviti kot X '··· H-X, kjer je X tisto, kar je znano kot darovalec vodikovega mostu, ker je kovalentno povezan z vodikom (daje ga).
Medtem je X 'sprejemnik vodikovega mostu, ki je prisoten v sosednji molekuli (prejme). Tako imamo atom darovalca (x), vodik (h) in atom sprejemnika (x '), ki sestavlja vodikov most (x' ··· H-X).
Geometrijski
Ko pomislimo na most, ravne ali obokane površine pridejo na misel. Ker se domneva, da se povezave ne ukrivijo, bomo imeli dve razdalji: x ··· H in H-X, ki sestavljajo vodikov most x ··· H-X.
Vam lahko služi: nepopravljiva reakcija: značilnosti in primeriMed tema dvema razdaljama je kot, ki je pogosto 180 °; To pomeni, da trije atomi našega mostu počivajo na isti vodoravni (ali navpični) črti.
Ko se kot razlikuje od 180 °, most X ··· H-X ni več raven ali linearn, ampak pridobi druge geometrije.
Po drugi strani razdalje v vodikovih mostovih niso enake. Razdalja H-X je krajša od x ··· H, ki jo lahko vidimo na sliki molekul vode. Tako je na primer razdalja H-X običajno 230 (1 · 10-12m), medtem ko je druga razdalja x ··· h 160:00 naprej.
Asociativno
Posebna značilnost vodikovega mostu je, da molekule omogoča, da so med seboj veliko bolj povezani. Ne hodijo od strani do drugega in se ignorirajo. Zato vzpostavlja trenutni red v prsih tekočin; In v primeru trdnih snovi prispevajo k definiciji svojih kristalov.
Kjer vidimo vodikov most, si lahko omislimo povezanost in torej v določenem zaporedju (čeprav dinamični in spreminjajoči se) na molekularne lestvice.
Energija
Razbijanje vodikovega mostu ni zelo težko. Na primer, molekule vode hodijo in ustvarjajo vsakič, ko mobilizirajo. Toda razbijanje številnih od njih bi pomenilo neureditev neskončnega števila molekul. Govorimo o zagotavljanju takšne energije, ki razbije mole teh vodikovih mostov (6.02 · 1023 X ··· H-X).
Tako se sila vodikovega mostu razlikuje glede na identiteto in naravo molekul. Na primer, sila vodikovega mostu ali ··· H-O med vodo in alkoholom je 5 kcal/mol: 5 kcal energije je potrebno za razbijanje mola tega vodikovega mostu.
Vam lahko služi: kemične spremembe: značilnosti, primeri, vrstePrimeri vodikovih mostov
Voda
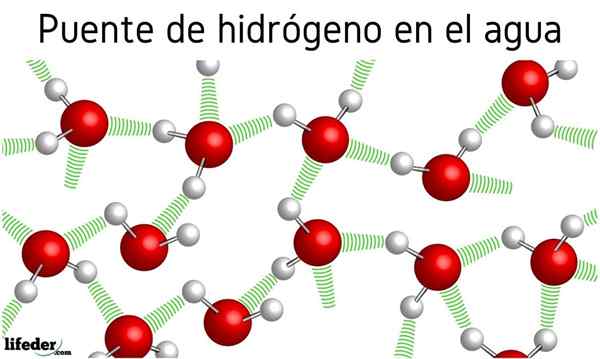
Sprva so govorili o vodikovih mostovih med molekulami vode, vendar učinek, ki ga ima na njihove lastnosti, ni bil omenjen. Zahvaljujoč jim, da voda zavre pri 100 ° C, pušča vrelišča povezanih molekul, kot je H2S, ki zavre pri -60 ° C; ali h2Vem, zavre pri -41.25 ° C.
Ta absmalna razlika je posledica vodnih vodikovih mostov, ki opredeljujejo tudi druge anomalne lastnosti, kot so ogromna specifična toplota, ledena kristala, njihova dielektrična konstanta itd.
Etanol
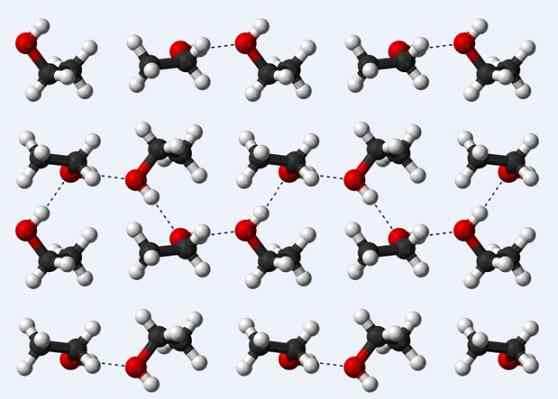 Vodikovi mostovi v kristalu etanola
Vodikovi mostovi v kristalu etanola Zdaj pa si oglejmo še en vodikov most: tisti med molekulami etanola, ch3Pogl2Oh (zgoraj). Upoštevajte, kako so nameščene molekule3Pogl2Oh tako, da so vzpostavljeni njihovi vodikovi mostovi3Pogl2Ho ··· hoch2Pogl3 (pikčaste črte).
Vendar pa so molekule preveč naročene, da bi domnevali, da govorimo o tekočem etanolu, ampak namesto tega sestavljamo kozarec (trden etanol).
Vodikov most, opisan za etanol.
Ocetna kislina
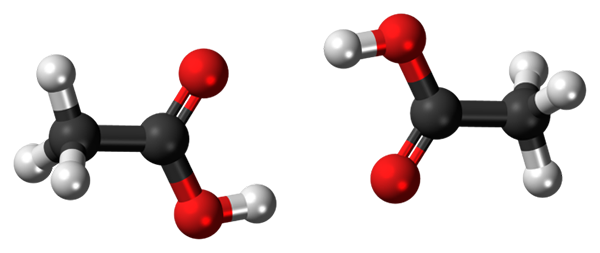 Vodikovi mostovi med dvema molekulama ocetne kisline. Vir: Jynto, CC0, prek Wikimedia Commons
Vodikovi mostovi med dvema molekulama ocetne kisline. Vir: Jynto, CC0, prek Wikimedia Commons Ocetna kislina, cho3COOH, lahko vzpostavi dva vodikova mostova, ki združujeta dve molekuli hkrati. Ker gre za dve molekuli, ki jih povezujeta vodikov mostovi, govorimo o dimeru.
Upoštevajte, da je eden od teh vodikovih mostov C = O ··· H-O in drugi O-H ··· O = C. Ocetna kislina predstavlja posebnost, da v parni fazi obstaja kot ta dimer.
Lahko vam služi: manganska ali permanganska kislinaCeluloza
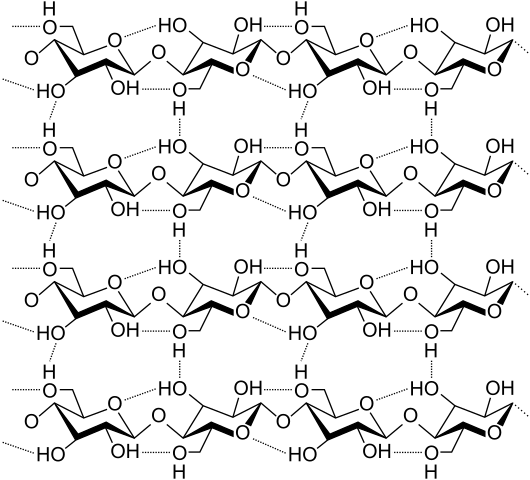 Vodikovi mostovi med več celuloznimi verigami. Vir: Laghi.L, cc by-sa 3.0, prek Wikimedia Commons
Vodikovi mostovi med več celuloznimi verigami. Vir: Laghi.L, cc by-sa 3.0, prek Wikimedia Commons Zdaj si oglejmo bolj raznolike in več mostov vodikovih mostov. Celuloza, naravni polimer, je sestavljen iz verig, sestavljenih iz več enot β-glukoze.
Vsaka veriga ostane pritrjena na drugo zahvaljujoč številnim vodikovim mostom (vrhunska slika), ki krepi kohezijo med verigami.
DNK
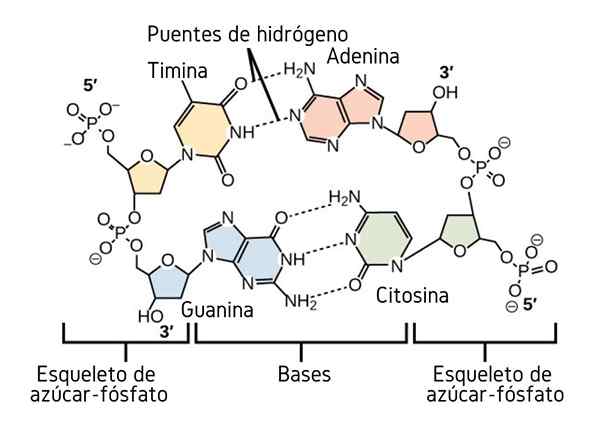 Vodikovi mostovi med dušikovimi bazami DNK. Vir: CNX OpenStax, CC do 4.0, prek Wikimedia Commons
Vodikovi mostovi med dušikovimi bazami DNK. Vir: CNX OpenStax, CC do 4.0, prek Wikimedia Commons Do zdaj smo videli asociativni učinek vodikovih mostov, da bi uvedli red med molekulami. Kaj pa makromolekula? V makromolekuli, kot je DNK, najdemo notranje ali intramolekulske vodikove mostove med njegovim timinom, adeninom, gvaninom in citozinom (zgoraj) (zgoraj).
Intramolekularni vodikovi mostovi med temi pari dušikovega osnovnega parov, da molekula DNK pridobi dvojno strukturo propelerja, ki je idealna za njegovo podvajanje. Če bodo ti vodikovi mostovi prekinjeni s segrevanjem, se bo dvojni propeler odprl v dveh posameznih segmentih ali pasovih.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Edward e. ÁVILA & ASILé J. BlackBerry. (2004). Most vodika in njegove aplikacije povezava. University of Los Andes, Fakulteta za znanost, Oddelek za kemijo.
- Wikipedija. (2020). Vodikova vez. Pridobljeno iz: v.Wikipedija.org
- Pietri J. & Clark J. (21. avgusta 2020). Vezanje vodika. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Uredniki Enyclopeedia Britannica. (2020). Vezanje vodika. Okrevano od: Britannica.com
- Čelada, Anne Marie, ph.D. (29. oktober 2020). Kateri je primer vezave vodika? Okreval od: Thoughtco.com

