Amonijev sulfat
- 1043
- 35
- Barry Ernser
Pojasnjujemo, kaj je amonijev sulfat, njena kemična struktura, fizikalne in kemijske lastnosti ter uporabe
Kaj je amonijev sulfat?
On amonijev sulfat To je trojna in amonijanska anorganska sol žveplove kisline. Njegova kemična formula je (NH4)2SW4. Zato stehiometrični deleži pravijo, da za vsak sulfatni anion obstajata dva amonijeva kationa, ki delujeta z njim. To omogoča nevtralnost soli ((+1) ∙ 2 + (-2)).
Njegova nomenklatura je posledica dejstva, da je sol, pridobljena iz H2SW4, Spreminjanje "uric" pripona za "ato". Tako se dva začetna protona nadomesti z NH4+, produkt reakcije z amoniakom (NH3). Torej, kemična enačba za njegovo sintezo je: 2 NH3 + H2SW4 => (NH4)2SW4
Amonijev sulfat pripravimo tudi z reakcijo amonijevega karbonata s kalcijevim sulfatom: (NH4)2Co3 + Ovitek4 => (NH4)2SW4 + Tat3, Ogavanje karbonata kalico, ki je ločen od preostale tekočine.
Amonijev sulfat je skladiščenje dušika in žvepla, tako nujno v kemiji tal in gnojilih.
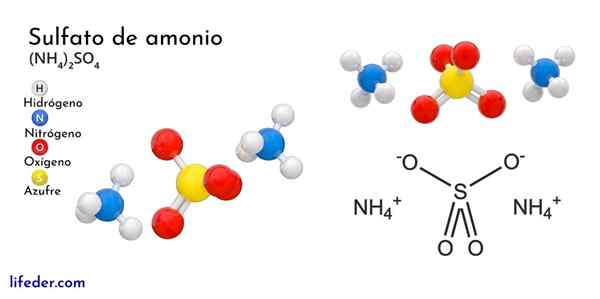
Kemična struktura amonijevega sulfata

Vrhunska slika ponazarja molekularne geometrije NH ionov4+ In tako42-. Rdeče sfere ustrezajo atomom kisika, bele do vodikove atome, modre do dušikovega atoma in rumene do žveplove atoma.
Oba iona lahko štejemo za dve tetraedri, tako da imata tri enote, ki se medsebojno medsebojno ukvarjajo s kristalnim razporeditvijo. Sulfatni anion je tako42- In lahko podari ali sprejme štiri vodikove mostove, pa tudi NH kation4+.
Lastnosti amonijevega sulfata
Molekularna teža
132,134 g/mol.
Lahko vam služi: odnos kemije in tehnologije s človekom, zdravjem in okoljemFizični videz
Bela trdna. Beli ali rjavi ortrorrambični kristali, odvisno od ravni nečistoč.
Vonj
Stranišče.
Tališče
280 ° C. Ta tališče, pod drugimi ionskimi spojinami, je zato, ker gre za sol z monovalentnimi kationi (+1) in s preoblekami.
Topnost
76,4 g/100 g vode pri 25 ° C. Ta afiniteta do vode je posledica velike zmogljivosti njihovih molekul za reševanje amonijevih ionov. Po drugi strani pa je netopna v acetonu in alkoholu; torej v manj polarnih topilih kot voda.
Gostota
1,77 g/cm3 pri 25 ° C.
Parni tlak
1.871 kPa pri 20 ° C.
Plamenišče
26 ° C.
ph
5,0 - 6,0 (25 ° C. Rešitev 1 m). Rahlo kisel pH je posledica NH hidrolize4+ V vodi, ki proizvaja H3Tudi+ pri nizkih koncentracijah.
Stabilnost
Stabilen v ustreznih okoljskih razmerah. V stiku z močnimi oksidanti lahko zažge.
Razgradnja
Začne se razgraditi pri 150 ° C, sprošča strupene hlape žveplovega oksida, dušikovega oksida in amonija.
Korozija
Ne napada železa ali aluminija.
Uporaba amonijevega sulfata
V kmetijstvu
- Amonijev sulfat se uporablja kot gnojilo v alkalnih tleh. Amonijeva sol ima 21 % dušikovega in 24 % žvepla v svoji sestavi. Vendar obstajajo spojine, ki zagotavljajo količino dušika, večjo od amonijevega sulfata; Prednost slednjega je njegova visoka koncentracija žvepla.
- Žveplo je bistvenega pomena pri sintezi beljakovin, saj ima več aminokislin - na primer cistin, metionin in cistein - žveplo. Zaradi teh razlogov je amonijev sulfat še naprej eno najpomembnejših gnojil.
- Uporablja se v pridelkih pšenice, koruze, riža, bombaža, krompirja, konoplje in sadnih dreves.
- PH alkalnih tal navzdol za njihov prispevek v procesu nitrifikacije, ki ga izvajajo mikrobi. Uporablja se amonij (NH4+) za proizvodnjo nitrata (ne3-) in sprostitev h+: 2nh4+ + 42 => 2no3- + 2H2O + 4h+. Povečanje koncentracije vodika zmanjšuje pH alkalnih tal in omogoča več uporabe.
- Poleg uporabe kot gnojila amonijev sulfat deluje kot adjuvant topnih insekticidov, herbicidov in fungicidov, ki so razpršeni na pridelke.
- Sulfat je sposoben ugrabiti ione, ki so prisotni v tleh in namakalni vodi, ki so potrebni za življenje nekaterih patogenov. Med ioni, ki jih zajema amonijev sulfat2+, Mg2+, vera2+ in vera3+. To dejanje izboljšuje mikrobicidni učinek prej omenjenih agentov.
Kot analitični reagent
Amonijev sulfat deluje kot oborino v elektrokemični analizi, sredi mikrobiološke kulture in pri pripravi amonijevih soli.
Pri padavinah in izolaciji beljakovin
Amonijev sulfat se uporablja pri čiščenju izolacije in beljakovin, zlasti v plazmi. Za plazmo dodamo količino amonijevega sulfata, da jo popeljemo v določeno koncentracijo; Tako je nastala padavina beljakovinske skupine.
Oborino s centrifugiranjem se zbira in supernatant doda dodatna količina amonijevega sulfata in v novo koncentracijo nastaja padavina druge skupine beljakovin.
Ponavljanje prejšnjega procesa zaporedno omogoča pridobivanje različnih frakcij beljakovin v plazmi.
Preden so se pojavile nove tehnologije molekularne biologije, je ta postopek omogočil izolacijo plazemskih beljakovin, ki je zelo pomembna v medicini, na primer: imunoglobulini, koagulacijski faktorji itd.
V industriji
Amonijev sulfat deluje tako, da odloži začetek požara v tekstilni industriji. Uporablja se kot dodatek v industriji Electroenchapado. Uporablja se tudi pri proizvodnji vodikovega peroksida, amonijevega klorida itd.
Druge uporabe
- Amonijev sulfat se uporablja kot regulativno sredstvo osmotskega tlaka in kot oborino, ki.
- V obliki amonijevega sulfata Lauril zmanjšuje površinsko napetost vode in tako omogoča ločevanje onesnaževal s povečanjem trdote vode.
- Je antikorozivno sredstvo.
- Uporablja se kot aditiv za hrano, ki uravnava kislost v moki in kruhu.
- « Koncept poslanstva in osebne vizije, kako jih narediti, primeri
- Poznejše soli, kaj so, nomenklatura, lastnosti, primeri »