Oktetno pravilo

- 3537
- 1132
- Miguel Gutmann DVM
 Predstavitev molekule ogljikovega dioksida, ki prikazuje skladnost s pravilom okteta
Predstavitev molekule ogljikovega dioksida, ki prikazuje skladnost s pravilom okteta Kaj je pravilo okteta?
The Oktetno pravilo To je praktično pravilo, ki pojasnjuje oblikovanje kemične vezi reprezentativnih elementov, ki temelji na elektronski konfiguraciji njene valenčne plasti.
V skladu s tem pravilom se atomi združujejo med seboj tako, da je vsak atom obkrožen z osem elektronov v svoji valenčni plasti (od tod tudi beseda oktet).
To pravilo je bilo objavljeno istočasno v 1.916 oba Gilbert Lewis in Walther Kossel. Odseva opazovanje, da so plemenite plini zelo stabilni in vsi, z izjemo helija, je značilno, da imajo svojo valenčno plast z 8 elektroni.
Teorija določa, da atomi delijo ali izmenjujejo elektrone z oblikovanjem kemičnih vezi, da bi pridobili to celovito elektronsko konfiguracijo s polnim slojem.
Strukture okteta in Lewis
Strukture okteta in Lewis so tesno povezane. To je zato, ker je pravilo okteta ena od baz za razumevanje tvorbe kemične vezi, zato omogoča napovedovanje v večini primerov Lewisovo strukturo kemikalij.
V tem smislu je eden od bistvenih korakov za risanje Lewisove strukture po postavitvi preprostih povezav med vsemi atomi, ki tvorijo molekulo.
V primerih, ko so okteti brez polnjenja, se oblikujejo dvojne ali trojne vezi in vedno iščejo pravilo okteta za čim več atomov. Torej je to empirično pravilo bistveno za gradnjo Lewisovih struktur.
Lahko vam služi: Silver Yoduro (AGI): Struktura, lastnosti, pridobivanje, uporabePrimeri skladnosti s pravilom okteta
Pravilo okteta se uporablja predvsem za reprezentativne elemente, torej za tiste iz blokov S in P periodične tabele. To pravilo se dosledno uporablja za spojine, ki vsebujejo ogljik, dušik, kisik in halogene ter z nekaj izjemami od drugih elementov P bloka P. Vendar večina prehodnih kovin ne upošteva.
Nekaj primerov spojin, v katerih je pravilo okteta izpolnjeno za vse atome, je:
Ogljikov dioksid (co2)
Kot je razvidno iz Lewisove strukture ogljikovega dioksida spodaj, tako osrednji ogljik kot oba atoma kisika ustrezata pravilu okteta.
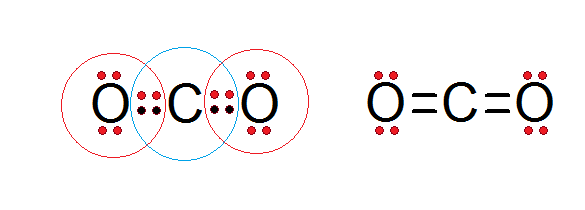
Ogljik je obdan s svojimi 4 valenčnimi elektroni in dvema elektronoma iz vsakega kisika, ki prispevata k oblikovanju dvojnih vezi c = o, medtem ko je vsak kisik obkrožen s 6 lastnimi elektroni plus par iz ogljika.
Neopentano (c5H12)
V veliki večini organskih spojin vsi atomi izpolnjujejo oktetno pravilo (razen vodika, ki ga obdajajo samo 2 elektrona). To vključuje alkane, kot sta Neopentano ali 2,2-dimetilpropane:
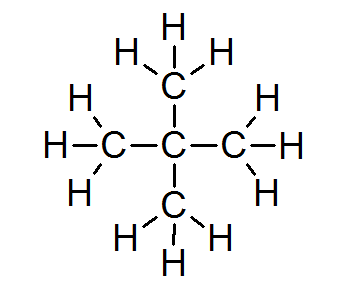
V tem primeru je tudi razvidno, da vsak ogljikov atom deli svoje štiri elektrone s 4 sosednjimi atomi, od katerih vsak zagotavlja enega od svojih elektronov, da tvori 4 preproste kovalentne vezi, ki ohranjajo skupaj.
Zaradi tega je vsak ogljikov atom obkrožen z 8 valenčnimi elektroni, ki izpolnjujejo pravilo okteta.
Vam lahko služi: aktivacijska energijaOgljikov monoksid (CO)
Ogljikov monoksid je še ena molekularna spojina, v kateri si kisik in ogljik delita elektrona, ki tvorijo kovalentno vez, da bi zadovoljili pravilo okteta.
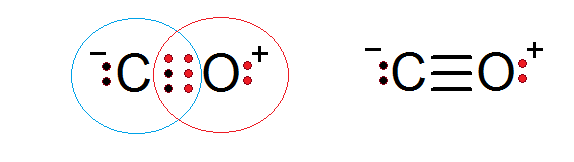
V tem primeru Carbon zagotavlja dva elektrona in kisik 4 za dokončanje 6 elektronov, potrebnih za oblikovanje trojne kovalentne vezi, ki jih združuje. Vsak od obeh atomov ima dodatne elektrone, ne da bi delili, ki dokončajo vsak oktet.
Nitratni anion (ne3-)
Tudi v primeru ionov je pravilo okteta izpolnjeno. Nitratni ion ima osrednji dušikov atom, obkrožen s 3 atomi kisika.
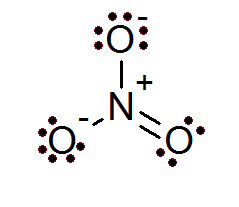
Kot je razvidno iz tega, imajo vsi atomi svoj polni oktet, dva kisik imata negativno formalno obremenitev, medtem ko ima dušik pozitivno formalno obremenitev, kar ima za posledico neto obremenitev -1 nitratnega iona.
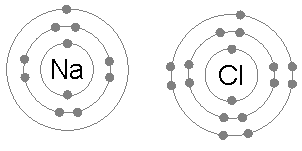
Natrijev klorid (NACL)
Izmenjava elektronov, ki tvorijo ionske spojine, je tudi pogost primer uporabe oktetskega pravila.
Ko natrijev klorid nastane iz klora in natrija, se začne iz dveh atomov, ki ne izpolnjujeta pravila okteta, saj natrij na elektronu in kloru nima enega, da bi dokončal svoj oktet.
Nato natrij daje svoj elektron kloru, pusti kation, obkrožen z 8 elektroni, in po vrsti dokonča oktet do klora.
 Izjeme od pravila okteta
Izjeme od pravila okteta
Tako kot obstaja veliko število spojin, v katerih vsi atomi izpolnjujejo pravilo okteta, obstaja tudi več primerov atomov, ki tega ne izpolnjujejo.
Lahko vam služi: potencialne z: vrednosti, stopnje koagulacije, določitev, uporabeNekateri so obkroženi z manj kot 8 elektroni, zato so Slabe elektronske vrste, Medtem ko so drugi obkroženi z več kot osmimi elektroni, v tem primeru se reče, da ima razširjen oktet ali se imenuje Hipervalentni atom.
Primeri slabih elektronskih vrst
Bordean (BH3)
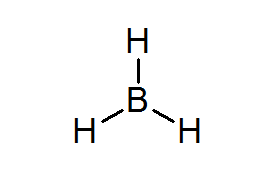
Ta spojina je značilen primer slabe vrste elektronov. Niti boron niti okoliški vodiki nimajo dovolj elektronov, da bi zadovoljili pravilo okteta v osrednjem atomu. To povzroči, da bo boron prejel nekaj elektronov iz drugega atoma v drugi molekuli, ki bo bordo spremenil v kislino iz Lewisa.
Aluminijast Triclurur (Alcl3)
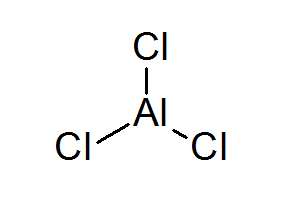
Alcl3 To je še en primer Lewisove kisline, ki dolguje svoje kemijsko vedenje, na katerega ne izpolnjuje pravila okteta.
Primeri hipervaluentnih vrst
Žveplo hexafluoruro (sf6)
Tipičen primer razširjenega okteta je SF6, ki je običajno predstavljen kot osrednji žveplo s 6 preprostimi kovalentnimi vezmi s fluoriranimi atomi. V tem primeru je žveplo obkrožen z 12 valenčnimi elektroni namesto 8, zato krši pravilo okteta.
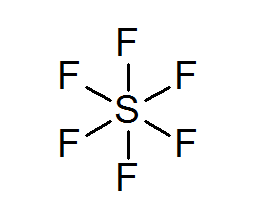
Kljub temu so bili predlagani modeli, v katerih je Sulfur dejansko povezan s kovalentnimi vezmi na 4 fluorje hkrati, medtem ko z ostalimi dvema tvorijo ionske vezi. Če je tako, bi izpolnil pravilo okteta.
Fosfor pentaklorid (PCL5)
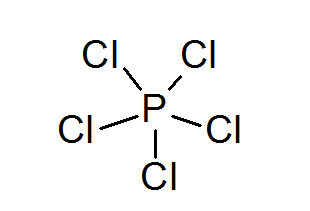
Kot v primeru žvepla, lahko tudi fosfor tvori spojine z razširjenimi okteti, v tem primeru obkrožene z 10 elektroni.

