Načelo Aufbau

- 4259
- 1068
- Raymond Moen
 Atomske orbitale zapolnjevanje vrstnega reda v skladu z načelom Aufbau
Atomske orbitale zapolnjevanje vrstnega reda v skladu z načelom Aufbau Kaj je načelo Aufbau?
On Načelo Aufbau, Znan tudi kot deževno pravilo ali načelo gradnje, je praktično pravilo, ki omogoča napovedovanje elektronske konfiguracije velike večine elementov periodične tabele, kot tudi njene ione.
To načelo ugotavlja, da se, ker se protoni dodajo jedru, eden za drugim za zaporedno grad.
Z drugimi besedami, Aufbau je ugotovil, da obstaja poseben vrstni red, po katerem je mogoče zapolniti atomske orbitale. To naročilo je razloženo spodaj.
Vrstni red polnjenja orbitalov po načelu Aufbau
Vrstni red, v katerem so zapolnjene atomske orbitale, je odvisen od njihove ravni energije. Zlato pravilo je, da so te ravni energije napolnjene od najmanj do največje.
V tem smislu moramo za napoved vrstnega reda zapolnjevanja orbitalov najprej vedeti, kako so naročeni glede na njihovo energijsko raven. V analogiji stavbe to pomeni, da veste, katera (orbitalna) stanovanja so v vsakem nadstropju.
Naslednja grafika prikazuje ravni energije prvih atomskih orbitalov, urejenih od najnižje do večje energije.
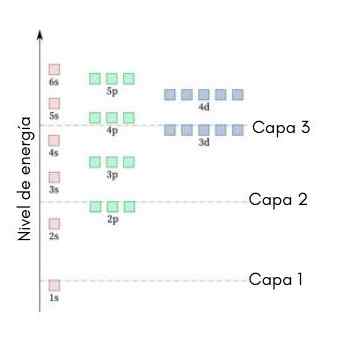
Na tej sliki vsaka slika predstavlja določeno orbitalo, v kateri se prilegajo le 2 elektroni. Vsaka skupina slik iste barve predstavlja pod -nivo energije.
Te podloge so identificirane s številko in črko (1s, 3p, 3d itd.). Številka označuje glavno raven energije, črka pa označuje vrsto orbitala, ki tvori skupino.
Lahko vam služi: aluminijev klorid (ALCL3)V skladu s to shemo je prva pod -ravni, ki jo je treba zapolniti.
Pravilo dežja
Kljub temu, kako enostavno je vzpostaviti vrstni red polnjenja, če imate graf, kot je prejšnji, si je težko zapomniti določen vrstni red, v katerem gre. Za to se uporablja tisto, kar nekateri imenujejo "pravilo dežja".
To pravilo je sestavljeno iz dveh preprostih korakov:
Korak 1
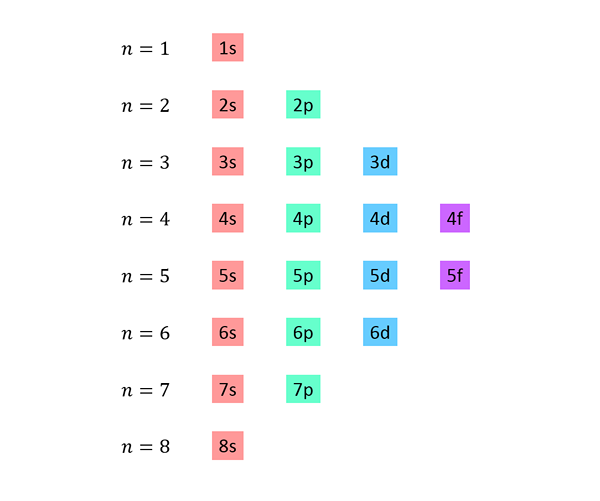
Sestavljen je seznam, v katerem vsaka vrstica ustreza ravni energije in vsebuje drug za drugim, vse podloge, ki so na voljo na tej ravni energije.
Na primer, prva vrstica ustreza stopnji 1 (n = 1) in vsebuje samo 1S pod -ravni; Druga vrstica ustreza nivoju n = 2 in vsebuje 2s in 2p pod -ravni; Tretji vsebuje 3S, 3P in 3D pod -ravni ipd.
Celoten seznam izgleda tako:
2. korak
Spuščajoče diagonale se narišejo od desne proti levi, ena pod drugo, kot je prikazano spodaj.
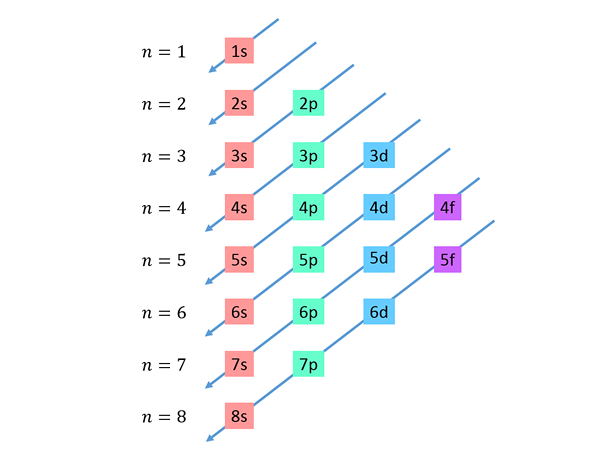
Te črte spominjajo na pot kapljic vode med vetrom z vetrom, zato se ta graf običajno imenuje "Metoda dežja". Naročilo za polnjenje je določeno z vrstnim vrstom, v katerem se te diagonale dotikajo pod -ravni na seznamu.
Na podlagi prejšnje številke je vrstni red energije orbital in torej vrstni red, v katerem je treba zapolniti,:
Vam lahko služi: kvantna tabela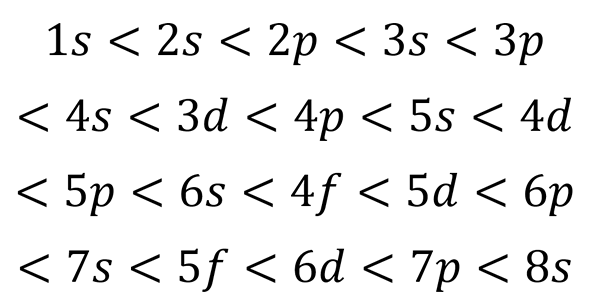
Ta naročilo za polnjenje je edini, ki je resnično pomemben pri pisanju elektronske konfiguracije atoma. Pri polnjenju teh pod -ravni si je treba zapomniti, da v pod -stopnjah s Samo 2 elektrona se prilegata str fit 6, v d Prilegajo se 10 in v F Ustrezajo 14.
Izjeme na začetku Aufbaua
Načelo Aufbau jasno ugotovi, da pod -ravni ni mogoče zapolniti, dokler se vsi predhodni podložnici niso popolnoma zapolnili. Vendar pa obstaja nekaj izjem pri tem pravilu.
V nekaterih primerih ima atom raje pod -nivo energije, napolnjeno natančno na polovici, kot da ima nepopolno, ki ni polna na polovico. V teh primerih se dejanska elektronska konfiguracija atoma ne ujema s predvidenim vrstnim redom z metodo dežja.
Na primer, po načelu Aufbau bi moral krom atom imeti elektronsko konfiguracijo, ki se konča v 4S2 3D4. Vendar je njegova resnična konfiguracija 4S1 3D5 Ker sta torej 4S in 3D -pod -ravni zapolnjeni na polovici, medtem ko v drugi konfiguraciji št.
Enako velja za baker, katerega konfiguracija se konča v 4S1 3D10, namesto 4s2 3D9, Ker je tako napolnil sub -ravni d in s, je polno na polovici.
Primeri uporabe načela Aufbau
Nato obstaja 5 primerov elementov, ki ustrezajo načelu Aufbau:
Primer 1: Natrijeva elektronska konfiguracija
Natrij je element 11, tako da ima 11 protonov in 11 elektronov. Njegova elektronska konfiguracija je 1s2 2s2 2 p6 3s1.
Primer 2: Argon Elektronska konfiguracija
Argon (AR) je element 18, zato ima 18 protonov in 18 elektronov. Njegova elektronska konfiguracija je torej 1s2 2s2 2 p6 3s23P6. Vidimo, da so bili njegovi podnaliki in p pod -ravni popolnoma.
Vam lahko služi: propilen (C3H6)Primer 3: Elektronska konfiguracija galijev
Gallium (GA) je element 31, tako da ima 31 protonov in 31 elektronov. Njegova elektronska konfiguracija je 1s2 2s2 2 p6 3s23P64s23D104p1.
To je mogoče zapisati na povzetek kot [ar] 4s23D104p1, kjer [AR] predstavlja konfiguracijo elektronskega argona, predstavljeno v prejšnjem primeru.
Primer 4: Elektronska konfiguracija ogljika
Carbon (C) je element 6, tako da ima 6 protonov in 6 elektronov. Njegova elektronska konfiguracija je 1s2 2s2 2 p2.
Primer 5: Elektronska konfiguracija klora
Klor (CL) je element 17. Njegovih 17 elektronov je razporejenih v skladu z naslednjo elektronsko konfiguracijo: 1S2 2s2 2 p6 3s23P5 ali [ne] 3s23P5.
Dodatni primeri izjem na začetku Aufbaua
Nato obstajata dva dodatna primera elementov, ki kršijo načelo Aufbau:
Primer 6: Elektronska konfiguracija molibdena
Molybden (MO) je element 42. Prvih 36 elektronov je razporejenih na enak način kot v Cryptonu, vendar njeni valenčni elektroni ne sledijo običajnemu vrstnemu redu. Namesto da bi imeli elektronsko konfiguracijo [KR] 5S24d4, Njegova konfiguracija je [KR] 5S14d5, Podobno kot s Chromom.
Primer 7: Srebrna elektronska konfiguracija
La Plata (AG, element 47) predstavlja kršitev načela Aufbau, podobno kot pri. Njegova elektronska konfiguracija je [KR] 5S14d10 Namesto [Kr] 5s24d9.

