Keratinske vrste, struktura, lokacija in funkcije
- 4035
- 273
- Stuart Armstrong
The Keratin Gre za netopni vlaknasti protein, ki je strukturni del celic in celovitosti številnih organizmov, zlasti živali z vretenčarji. Ima zelo raznolike oblike in je malo reaktivno, kemično gledano.
Njegovo strukturo sta prvič opisala znanstvenika Linus Pauling in Robert Corey leta 1951, medtem ko sta analizirala strukturo živalskih las. Ti raziskovalci so tudi navedli o strukturi miozina mišičnega tkiva
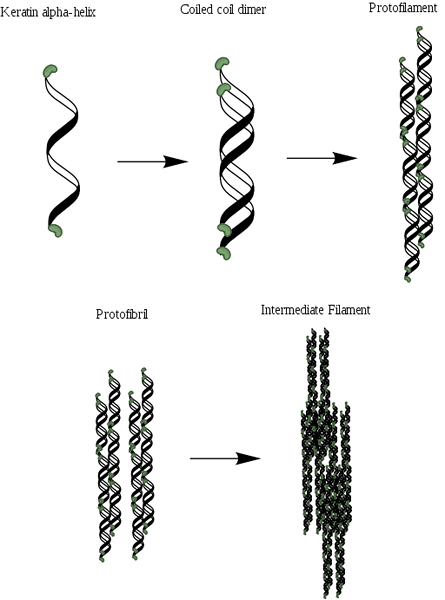
 Shema organizacije Alfa-Queratin (vir: Mlpatton [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons)
Shema organizacije Alfa-Queratin (vir: Mlpatton [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons) Po kolagenu je eden najpomembnejših beljakovin živali in predstavlja večino suhe teže las, volne, nohtov, krempljev, perja, rogov in velikega dela zunanje plasti kože.
"Keratinizirani" elementi živali imajo lahko zelo različne morfologije, ki so v veliki meri odvisne od funkcije, ki jo izvajajo v vsakem določenem organizmu.
Keratin je beljakovine, ki ima značilnosti, ki ji dajejo veliko mehansko učinkovitost v smislu napetosti in stiskanja. Proizvaja ga posebna vrsta celic, ki se imenujejo "keratinociti", ki običajno umrejo, potem ko ga proizvajajo.
Nekateri avtorji zatrjujejo, da so keratini izraženi na stadionu tkanine in odrov. Pri ljudeh je za te beljakovine več kot 30 kodirajočih genov in ti pripadajo družini, ki se je razvila za več krogov genetskega podvajanja.
[TOC]
Vrste keratinov in njihova struktura
V bistvu obstajata dve vrsti keratinov: α in β. Razlikujejo jih po tem, da posedujejo osnovno strukturo, ki je sestavljena predvsem iz polipeptidnih verig, ki jih je mogoče vpisati kot alfa propelerje (α-kvalinas) ali se vzporedno pridruži.
α-Queratinas
Ta vrsta keratina je najbolj preučena in znano je, da imajo sesalci vsaj 30 različnih različic te vrste keratina. Pri teh živalih so α-to del nohtov, las, rogov, čelad, konic in povrhnjice.
Tako kot kolagen tudi ti beljakovine vsebujejo v svoji strukturi obilen delež majhnih aminokislin, kot sta glicin in alanin, ki so tiste, ki omogočajo vzpostavitev alfa propelelov. Molekularna struktura α-kvalina je sestavljena iz treh različnih regij: (1) kristalne vlaknine ali propelerjev, (2) končne domene filamentov in (3) matrica.
Propelerji sta dva in tvorita dimer, ki spominja na navito spiralo, ki ostane združena, zahvaljujoč prisotnosti povezav ali disulfurnih mostov (S-S). Vsak od propelerjev ima približno 3.6 aminokislinskih odpadkov v vsakem zavoju, ki daje in je več ali manj 310 aminokislin.
Lahko vam služi: flora in favna ekvadorske Sierre: reprezentativna vrstaTe naviti spirala je lahko povezana, da tvorijo strukturo, znano kot protofilament ali protofibrila, ki se lahko sestavlja z drugimi iste vrste.
Protofilamenti imajo N- in C-terminale ne-spiralne konce, ki so bogati z ostanki cisteina in so pritrjeni na osrednjo regijo ali matrico. Te molekule polimerizirajo, da tvorijo vmesne filamente, ki imajo premer blizu 7 nm.
Razlikujeta se dve vrsti vmesnih filamentov, sestavljenih iz keratina: vmesne kisle filamente (tip I) in osnove (tip II). Te so vgrajene v beljakovinsko matrico in način naročanja teh filamentov neposredno vpliva na mehanske lastnosti strukture, ki sestavljajo.
V nitkah tipa I se propelerji med seboj povezujejo s tremi "vijačnimi konektorji", znanimi kot L1, L12 in L2, in ki naj bi zagotovili prožnost za spiralno domeno. V nitkah tipa II obstajata tudi dve poddomenami, ki sta med spiralnimi domenami.
Primer strukture z α-Queratinas: lasje
Če je analizirana struktura tipičnega las, ima približno premer 20 mikronov in je sestavljen iz mrtvih celic.
 Sesalski lasje, kot je ta krava, so sestavljeni iz keratina (vir: Frank Winkler prek Pixabay.CO)
Sesalski lasje, kot je ta krava, so sestavljeni iz keratina (vir: Frank Winkler prek Pixabay.CO) Makropibrili so sestavljeni iz mikrofibrilov, ki imajo manj premera in se med seboj združujejo skozi amorfno beljakovinsko snov z visoko vsebnostjo žvepla.
Te mikroobveščene skupine so skupine manjših protofibrilov z vzorcem organizacije 9+2, kar pomeni, da devet protofibril obdaja dva osrednja protofibrila; Vse te strukture so v bistvu sestavljene iz α-Queratin.
Mehki keratini in trdi keratini
Odvisno od vsebnosti žvepla, ki jo imajo, lahko α-Queratinas razvrstimo med mehke keratine ali trde keratine. To je povezano s silo mehanske odpornosti, ki jo nalagajo disulfidne povezave v beljakovinski strukturi.
V skupino trdih keratinov so vključeni tisti, ki so del las, rogov in nohtov, mehke keratine.
Disulfidne vezi lahko odpravimo z uporabo reducirajočega sredstva, tako da strukture, sestavljene iz keratina.
Lahko vam služi: fikologijaβ-Queratinas
Β-ki so veliko močnejši od α-kvalitarskih in jih najdemo v plazilcih in pticah kot del krempljev, lusk, perja in vrhov. V gekonih so mikrovije, ki jih najdemo v nogah (gob), sestavljene tudi iz tega beljakovin.
Njegova molekularna struktura je sestavljena iz listov, ki jih oblikujejo β, ki jih tvorijo antiparallete polipeptidne verige, ki se vežejo skozi vezi ali vodikovi mostovi. Te verige, poleg drugega, tvorijo majhne toge in ravne površine, rahlo zložene.
Kje ste in kakšne so vaše funkcije?
Funkcije keratina so predvsem povezane s vrsto strukture, ki jo gradi, in kraja telesa živali, kjer se nahaja.
Tako kot drugi vlaknasti proteini tudi celicam daje stabilnost in strukturno togost, saj spada v veliko družino beljakovin, znanih kot družina vmesnih filamentov, ki so beljakovine citoskeleta.
V zaščito in pokritost
Zgornja plast kože zgornjih živali ima veliko mrežo vmesnih filamentov, ki jih tvori keratin. Ta plast se imenuje povrhnjica in ima pri ljudeh debelo med 30 mikronov in 1 nm.
Povrhnjica deluje kot zaščitna ovira pred različnimi vrstami mehanskih in kemijskih napetosti in jo sintetizira posebna vrsta celic, imenovana "keratinociti".
Poleg povrhnjice obstaja še več zunanjega sloja, ki se nenehno premika.
Espinas in Púas uporabljajo tudi različne živali za lastno zaščito pred plenilci in drugimi agresorji.
"Oklep" pangolinov, nekaj majhnih sesalcev insektivoroznih sesalcev, ki naseljujejo Azijo in Afriko, je sestavljen tudi iz "lestvic" keratina, ki jih ščitijo.
V obrambi in drugih funkcijah
Rogove opazimo pri živalih iz družine Bovidae, torej pri kravah, ovcah in kozah. So zelo močne in odporne strukture in živali, ki jih imajo.
Rogovi tvorijo kostni center, sestavljen iz "gobaste" kosti, ki je prekrita s kožo, ki je projicirana iz zadnjega območja lobanje.
 Nohti so še en primer telesnih delov, sestavljenih iz keratina (vir: Adobe Stock prek Pixabay.CO)
Nohti so še en primer telesnih delov, sestavljenih iz keratina (vir: Adobe Stock prek Pixabay.CO) Kremplji in nohti poleg svojih funkcij v hrani in podpori služijo tudi živalim kot "orožje" obrambo proti napadalcem in plenilcem.
Vam lahko služi: fixistična teorija: koncept, postulati in avtorjiPtičji vrhovi med drugim izpolnjujejo več namenov, med katerimi hrana, obramba, udvaranje, izmenjava toplote in stranišče. V naravi najdemo več sort picosa pri pticah, zlasti glede na obliko, barvo, velikost in moč pripadajočih čeljusti.
Vrhovi so sestavljeni, tako kot rogovi, s kostnim središčem, ki je projiciran iz lobanje in je prekrit z odpornimi β-kvantnimi listi.
Zob nebelibulirane živali ("predniki" vretenčarjev) so sestavljeni iz keratina in imajo tako kot zobje "nadrejenih" vretenčarjev več funkcij v hrani in obrambi.
V gibanju
Čelade številnih prežvekovanih in uganih živali (konji, osli, alce itd.) Sestavljeni so iz keratina, so zelo odporni in zasnovani za zaščito nog in sodelovanje pri gibanju.
Perje, ki ga ptice uporabljajo tudi za premikanje, je sestavljeno iz β-pocenitve. Te strukture imajo poleg tega funkcije v kamuflaži, v udvaru, v toplotni izolaciji in v nepromobilnosti.
 Perje in vrh ptic je sestavljen tudi iz keratina (vir: Couleur, prek Pixabay.CO)
Perje in vrh ptic je sestavljen tudi iz keratina (vir: Couleur, prek Pixabay.CO) V industriji
Tekstilna industrija je eden glavnih izkoriščevalcev keratiniziranih struktur, antropocentrično gledano. Volna in lasje številnih živali so pomembni na industrijski ravni, saj so z njimi izdelani različna oblačila, ki so koristna za moške z različnih vidikov.
Reference
- Koolman, J., & Roehm, k. (2005). Atlas biokemijske barve (2. izd.). New York, ZDA: Thieme.
- Mathews, c., Van Holde, k., & Ahern, k. (2000). Biokemija (3. izd.). San Francisco, Kalifornija: Pearson.
- Nelson, d. L., & Cox, m. M. (2009). Lehningerjeva načela biokemije. Omega izdaje (5. izd.).
- Pauling, l., & Corey, r. (1951). Struktura las, mišic in sorodnih beljakovin. Kemija, 37, 261-271.
- Phillips, d., KORGE, b., & James, w. (1994). Keratin in keratinizacija. Časopis Ameriške akademije za dermatologijo, 30(1), 85-102.
- Rouse, j. G., & Dyke, m. In. Pojdi. (2010). Pregled biomaterialov na osnovi keratina za biomedicinske aplikacije. Materiali, 3, 999-1014.
- Smith, f. J. D. (2003). Molekularna genetika motenj keratina. Am J Clin dermatol, 4(5), 347–364.
- Voet, d., & Voet, J. (2006). Biokemija (3. izd.). Pan -american Medical uredništvo.
- Wang, b., Yang, w., McKitrick, J., & Meyers, m. Do. (2016). Keratin: struktura, mehanske lastnosti, pojav v bioloških organizmih in prizadevanja pri bioinspiraciji. Napredek v znanosti o materialih.
- « Nova Španija in odnosi s svetovnim ozadjem, poti
- Ponavljajoče se učne značilnosti, prednosti, slabosti »

