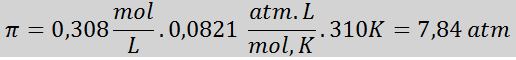Koligacijske lastnosti rešitev
- 1169
- 179
- Don Nitzsche
Kaj so koligativne lastnosti?
The Koligativne lastnosti, Imenovane tudi kolektivne lastnosti rešitev, so skupina štirih lastnosti, ki so odvisne izključno od količine delcev v raztopini, ne pa tudi od narave teh delcev.
Z drugimi besedami, te lastnosti izhajajo iz prisotnosti delcev, ki niso topila, torej delci topljenosti, vendar niso odvisni od tega, kdo je topilo. Vsaka vrsta delcev lahko povzroči koligativne lastnosti, ne glede na atomi, ioni ali molekule. Edino, kar je pomembno, je vaša koncentracija.
Koligacijske lastnosti so štiri:
- Odločitev pare tlaka topila
- Ebullloskopska višina
- Crioskopski spust
- Osmotski tlak
Za vse je značilno, da so sorazmerni s koncentracijo topljenca v primeru relativno razredčenih raztopin (koncentracija <0,2 M). Para soluciones más concentradas, el comportamiento se torna más complejo y difícil de analizar.
Poglejmo podrobno vsaka od teh štirih lastnosti:
1. Odločitev pare tlaka topila
Ko pripravimo ne -prolacijsko raztopino topljene raztopine, je parni tlak nastale raztopine vedno manjši od parnega tlaka čistega topila. Z drugimi besedami, v topilu raztopimo ne -propolapni topilo, povzroči znižanje parni tlak omenjenega topila v primerjavi s čistim topilom.
Formula pare tlaka zmanjšuje
Tako kot vse koligacijske lastnosti je tudi znižanje tlaka v pari (DP) sorazmerno s koncentracijo topljenosti. Če združi Raaultov zakon z enačbami molarne frakcije, je mogoče dokazati, da je DP podan z:
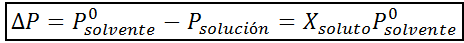
kjer je p °topilo predstavlja parni tlak čistega topila pri določeni temperaturi, Prešitev ustreza parni tlaku raztopine in xtopilo predstavlja koncentracijo topljene topljene, izražene kot molarna frakcija.
Zakaj znižuje tlak s paro s topilom?
Sila, ki poganja večino naravnih procesov, na primer izhlapevanje topila, je povečanje entropije ali stopnje motnje. Ko tekočina izhlapi, gre od zelo urejenega stanja (v tekočini) do zelo zmedenega (v plinu), saj je v plinski fazi veliko več svobode gibanja.
Vam lahko postreže: vijolično stekloVendar v raztopini prisotnost topljene dodaja motnjo tekoči fazi, hkrati pa ne vpliva na plinsko fazo (ker topka ne izhlapi).
Zaradi tega je razlika v stopnji motnje med raztopino in plinsko fazo manjša kot med čistim topilom in plinsko fazo, zato ima topilo v drugem primeru manj nagnjenosti k izhlapevanju.
Primer
Problem: Če veste, da je tlak vodne pare pri določeni temperaturi 30,55 mmHg, določite parni tlak pripravljene raztopine, ki raztaplja 7,20 grama glukoze (molarna masa ali MM = 180 g/mol) v 360 g vode (mm = 18,0 g/mol) pri isti temperaturi.
Rešitev: V tem primeru je treba najprej izračunati molarni delež topka. Za to že imamo vse potrebne podatke:
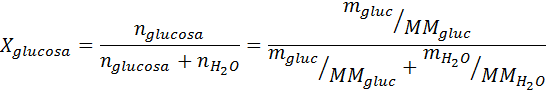
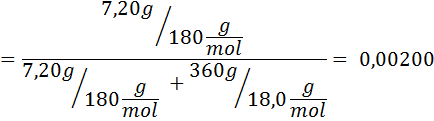
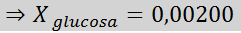
Nato se uporabi enačba zmanjšanja tlaka pare.
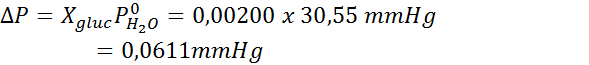
Zdaj določimo nov tlačni tlak topila:
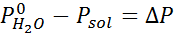
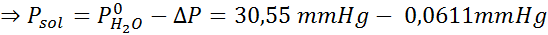
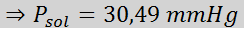
2. Ebullloskopsko višino ali vrelišče
Ebullloskopska višina se nanaša na povečanje vrelišča raztopine v primerjavi z vreliščem čistega topila. Če želite razumeti, zakaj se to zgodi, ne pozabite, da je vrelišče opredeljena kot temperatura, pri kateri se parni tlak tekočine izvajamo enako kot atmosferski tlak.
Ker imajo rešitve manjši parni tlak kot čisto topilo (kot smo šele videli v prejšnjem razdelku. Zaradi tega je vrelišče raztopin (z neemolacijskimi topili) vedno večje od točke čistega topila.
Formula ebullloskopske višine
Povečanje vrelišča (dtb) Je sorazmerna s koncentracijo topljene topljene, izražene v molealnosti, kot kaže naslednja enačba:
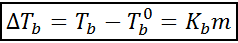
Kjer tb To je vrelišče raztopine, tb° To je vrelišče čistega topila, kb To je ebullloskopska konstanta topila in m To je molealnost topila.
Primer
Problem: Vedeti, da je vrela konstanta vode 0,52 ° C.kg/mol, določite vrelišče raztopine glukoze, pripravljene v prejšnjem primeru.
Rešitev: Za določitev ebulloskopske višine potrebujemo le moralo.
Vam lahko služi: kositer oksid (ii): struktura, lastnosti, nomenklatura, uporabe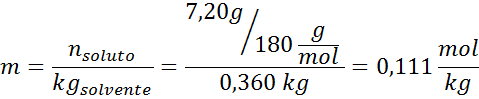
Zdaj uporabimo formulo DTb:
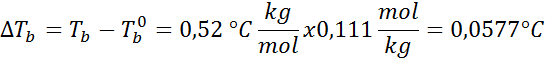
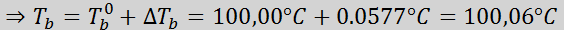
3. Crioskopski spust
Krioskopsko zmanjšanje je zmanjšanje zamrzovalne točke raztopine v primerjavi z zamrzovalno točko čistega topila. Razlog, da se to zgodi.
Ta lastnost se pogosto uporablja v hladnem vremenu, kjer pozimi sneži. V teh državah je zelo pogosto videti tovornjake, ki širijo soli, kot sta NaCl ali CACL2 na cestah ali na javnih klopeh, po katerih se topi sneg. Razlog, da se topi, je, da sol zmanjšuje točko zamrzovanja vode.
Formula za krioskopsko spuščanje
Krioskopska enačba spuščanja je zelo podobna kot pri ebulloskopskem povečanju. Sorazmerna je tudi z moralno koncentracijo in je v tem primeru odvisna od krioskopske konstante topila.
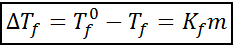
kjer tF To je zamrzovalna točka raztopine, tF° Je zamrzovalna točka čistega topila, kF To je kroskopska konstanta topila in m To je molealnost topila.
Primer
Problem: Vedeti, da je krioskopska vodna konstanta 1,86 ° C.kg/mol, določite zamrzovalno točko raztopine glukoze, pripravljeno v prejšnjem primeru.
Rešitev: Moralnost rešitve je bila že določena, zato lahko neposredno določimo DTF Uporaba prejšnje formule:
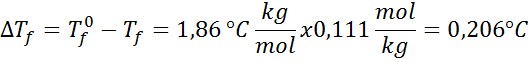
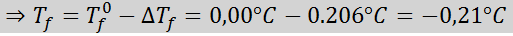
4. Osmotski tlak
Osmoza je proces velikega pomena na kemični in biološki ravni. To je sestavljeno iz pretoka molekul topila (na primer voda) iz razredčene raztopine v drugo bolj koncentrirano raztopino, ko jih ločimo s polprevodnim membrano (ki topilo omogoča samo, da topilo prehaja, ne pa topila).
Ta nagnjenost k "absorpciji" topila skozi polprepustno membrano je lastnost, ki je odvisna izključno od skupne koncentracije topnih delcev, ki so prisotni v raztopini, ne glede na to, kakšno je topljeno. Zaradi tega je ta trend koligativna lastnost in se meri z osmotskim tlakom.
Osmotski tlak (π) je tlak, ki ga je treba uporabiti za raztopino za zaustavitev osmoze. Večji kot je osmotski tlak, večja je težnja, da raztopina absorbira topilo (ali natančneje, več trenda, ki se širi proti tej raztopini) ima raztopino).
Vam lahko služi: magnezij: zgodovina, struktura, lastnosti, reakcije, uporabeZakaj pride do osmoze?
Pojasnilo, ki stoji za procesom osmoze, je zelo preprosta. Vse snovi se ponavadi širijo od tam, kjer so bolj koncentrirane tam, kjer so bolj razredčene. To naj bi sledili svojemu koncentracijskemu gradientu.
Ko je raztopina bolj koncentrirana v topilu, je hkrati bolj razredčena v topilu in obratno. Zaradi tega ima topilo naravno nagnjenost k prehodu iz najbolj razredčene raztopine (kjer je topilo bolj koncentrirano) proti najbolj koncentrirani raztopini (kjer je bolj razredčena).
Osmotski tlačni formula
Osmotski tlak lahko izračunamo s formulo, ki je zelo podobna enačbi idealnih plinov:
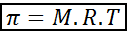
V tej enačbi je π osmotski tlak, m je molarna koncentracija topljenega, r je univerzalna konstanta idealnih plinov (0,0821 atm.L/mol.K) in t je absolutna temperatura v k.
Osmotski tlak in toničnost
Osmotski tlak je zelo pomemben za delovanje človeškega telesa. Pravzaprav so fiziološke raztopine, ki se intravensko vbrizgajo, razvrščene glede na to, ali je njihov osmotski tlak večji, enak ali manjši kot v krvni plazmi, ki jo imenujemo toničnost.
- Manj koncentrirana raztopina, da ima plazma nižji osmotski tlak in je rečeno Hipotonična rešitev.
- Če imate enako skupno koncentracijo topkov izotonična rešitev.
- Če imate večji osmotski (ali koncentracijski) tlak, je rečeno hipertonska rešitev.
Primer
Problem: Izračunajte osmotski tlak pri 310 K od 0,9% fiziološke raztopine (m/v), ki je izotoničen s krvno plazmo.
Rešitev: Temperaturo že imamo, zato manjka edina stvar, da v raztopini določimo molsko koncentracijo soli (NaCl). Za to.
Vsakih 100 ml raztopine vsebuje 0,9 g NaCl, torej:
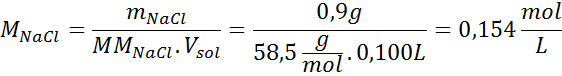
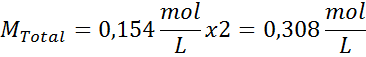
To je skupna koncentracija topnih delcev v raztopini, tako da lahko zdaj izračunamo osmotski tlak: