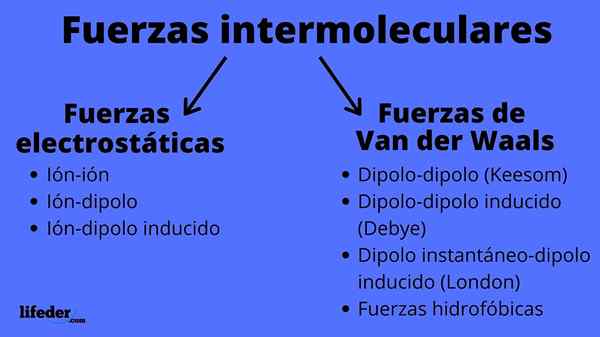
Medmolekularne sile
- 630
- 11
- Ms. Pablo Lebsack
 Shema vrst medmolekulskih sil
Shema vrst medmolekulskih sil Kaj so medmolekularne sile?
The Medmolekularne sile So nabor interakcij, ki potekajo med molekulami, ne glede na to, ali so enake kemične spojine ali ne, in jih ohranjajo skupaj. Zahvaljujoč tem silam molekule uspejo združiti in določiti trdno, tekočino ali plin; to pomeni, da so odgovorni za fizične lastnosti snovi.
Medmolekularne sile so lahko dveh vrst: elektrostatične ali van der Waals. Elektrostatični so vsi, kjer imamo ione, ki so električno obremenjeni atomi ali molekule (+ ali -). Medtem pa Van der Waals vključujejo nevtralne atome ali molekule, ki se z nihanji v njihovi elektronski porazdeli.
Medmolekularne sile lahko primerjamo z obstoječo zvezo med različnimi deli laikov. Odvisno od njihovih oblik in smernic postanejo njihovi sindikati šibkejši ali šibkejši, tako kot spreminjajo oblikovanje in končne dimenzije gradnje.
Močnejše so te sile, težje bo ločiti koščke laikov ali v primeru kemije molekul. To pomeni tudi, da bo večje stiskanje in da bodo zato molekule opredelile več viskoznih tekočin, težjih ali gostejših plinov.
Druge fizikalne lastnosti, kot so fuzijska in vrelišča, nestanovitnost, tekstura itd., So tudi makroskopski refleksi medmolekulskih sil, ki upravljajo med molekulami ali ioni spojine ali mešanic. Na primer: medmolekularne sile plinov so zelo šibke v primerjavi s kamen.
Razumevanje medmolekulskih sil je bistvenega pomena za opis številnih kemičnih, fizičnih in bioloških konceptov.
Elektrostatične sile
Ion-ion
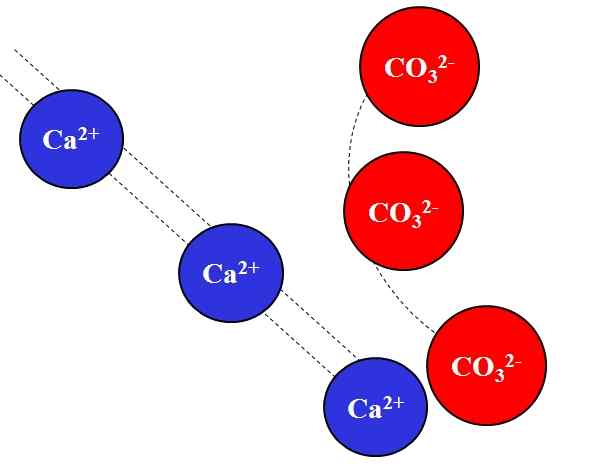 Elektrostatična privlačnost med ioni Ca2+ in Co32-. Vir: Gabriel Bolívar.
Elektrostatična privlačnost med ioni Ca2+ in Co32-. Vir: Gabriel Bolívar. Ioni nasproti obtožb privlačijo z veliko silo, kar je posledica Coulombovega zakona, in hitro zmanjša, bolj se ioni odmaknejo.
Na primer Ca ion2+ Je pozitiven naboj, kation, medtem ko je co32- Gre za negativni ion, anion. Biti nasprotne obremenitve, Kalifornija2+ in co32- Pritegnejo drug drugega, kar dokazujejo, da ko bodo bližje, bolj bodo ostali.
Nasprotno se ioni z enako obremenitvijo, bodisi pozitivni ali negativni, odbijajo z isto silo, vendar v nasprotnem smislu. Tako CA2+ Odbija na ione, kot je Na+, Mg2+, K+, itd., razen če obstajajo drugi anioni, ki zmanjšujejo odbojnost.
Lahko vam služi: dibenzalacetona: lastnosti, reakcijski mehanizem, uporabe, tveganjaOd vseh medmolekulskih sil so najpreprostejši tipi ionskega ionskega tipa; Toda hkrati je najmočnejši od vseh. Za ločevanje ionov je potrebno veliko energije ali toplote.
Ion-dipolo
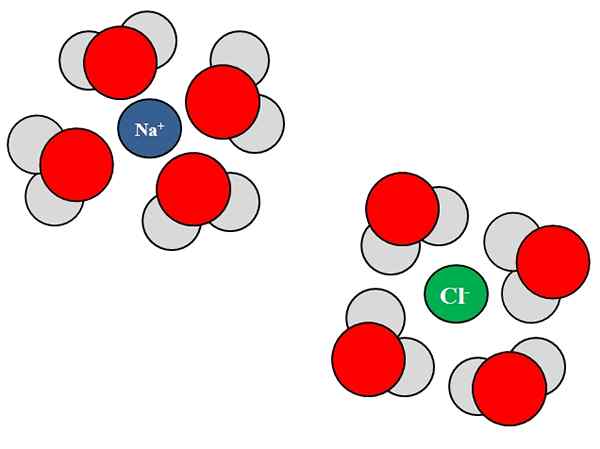 Interakcije ionskih dipolo med molekulami vode in NaCl ioni. Vir: Gabriel Bolívar.
Interakcije ionskih dipolo med molekulami vode in NaCl ioni. Vir: Gabriel Bolívar. Ioni lahko delujejo tudi z nevtralnimi atomi ali molekulami, kot je voda. To še posebej velja, ko gre za molekule topila, ki solvata, torej obkroža ione znotraj njihove tekočine.
Na primer natrijev klorid, NaCl, je sestavljen iz ionov NA+ in Cl-. Ko se njihovi kristali vržejo v vodo, molekule vode, h2O ali hoh, hidrira ali obdaja ione NaCl; Toda način, kako to počnejo, se razlikuje glede na zadevni ion.
Tako na vrhunski podobi vidimo, da je ion na+ je hidriran s H h kisikovimi atomi2Tudi. Medtem ion cl- je hidriran z vodikovimi atomi.
Ker? Ker je voda polarna snov, kar pomeni, da ima dipol: drog s pozitivno delno obremenitvijo in drugi z negativno delno obremenitvijo.
Atom kisika, ker je bolj elektronegativen, privlači elektrone k sebi in tako pogosteje locira elektrone okoli tega atoma; nekaj, kar se ne zgodi enako z vodikovimi atomi, manj elektronegativnega. Kisik, ker je bolj negativen, je usmerjen v NA+; Medtem ko so vodiki, ker so bolj pozitivni, usmerjeni v CL-, Ker se privlačijo nasprotne stroške.
Inducirani ion-dipolo
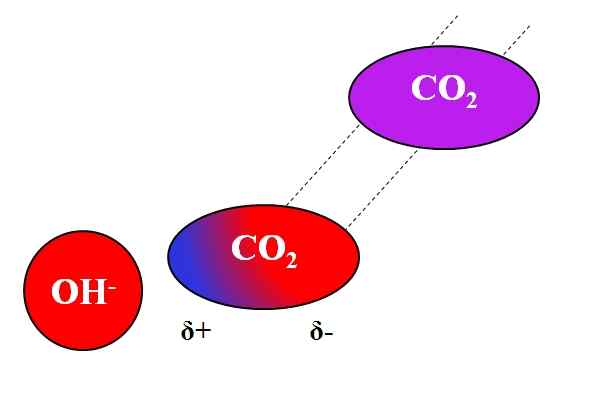 Induktivno delovanje oh- na molekuli Co₂. Vir: Gabriel Bolívar.
Induktivno delovanje oh- na molekuli Co₂. Vir: Gabriel Bolívar. Ne samo polarne ali dipolesove molekule lahko medsebojno delujejo z ioni. Za nevtralne atome ali molekule, tudi če nimajo dipolov, je porazdelitev njihovih elektronov dovzetna za induktivne učinke bližnjih ionov; to pomeni, da ioni povzročajo trenutno in kratko polarizacijo, dovolj za opazno interakcijo.
Vam lahko služi: svinčeno acetat: struktura, lastnosti, pridobivanje, uporabeRecimo na primer interakcija med OH ionom- in co2. Co2 Je nevtralna spojina, katere molekule (v vijolični) primanjkuje dipola. Vendar se, ko se približa OH-, Negativna obremenitev tega odbija na elektrone kisikovih atomov CO2.
Bližje OH so- in co2, močnejša bo odbojnost. Posledično se začne dipol, ki ga povzroči OH- O co2. Pozitiven pol se pojavi Δ+, ker so elektroni, odvrženi, "izseli" na drugi konec molekule.
Tako, oh- in co2 Ostaneta dovolj skupaj, da se med seboj reagirata. To je razlog, zakaj2 V alkalnih rešitvah je še posebej topen.
Van der Waals sile
Sile Van Der Waalsa se načeloma nanašajo le na tiste, ki obstajajo med nevtralnimi atomi ali molekulami, brez ionskih obremenitev.
Dipolo-dipolo (KEESOM)
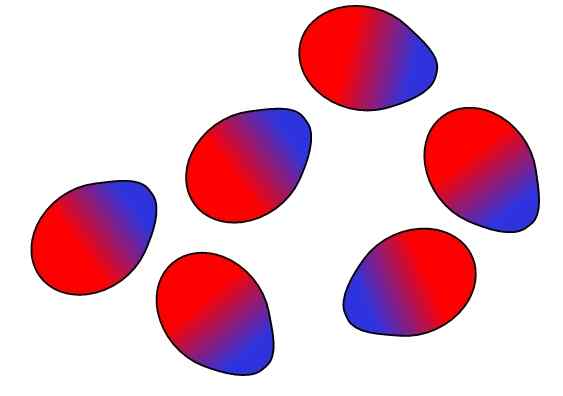 Sile dipolo-dipolo. Vir: Gabriel Bolívar.
Sile dipolo-dipolo. Vir: Gabriel Bolívar. Nasprotni naboji so privlačni, enake obremenitve se odbijajo. Enako velja za dipole: privabljajo se nasprotni drogovi (Δ+ in Δ-), medtem ko se enaki drogovi odbijajo. Pozitivni drogovi ali Δ+ so zgoraj predstavljeni z modro barvo, vendar so negativni drogovi ali δ- predstavljeni z rdečo barvo.
Upoštevajte, kako so zgornje molekule usmerjene in urejene tako, da so nasprotni drogovi, ki se odmikajo v proces do enakih polov. To naročanje je tisto, kar je znano kot interakcije ali sili dipolo-dipolo (sile KEESOM) in so najpomembnejše medmolekularne sile med polarnimi molekuli.
Na primer h molekule2Ali, hcl, hf, co, med drugim so naročeni v podobnih načinih. Bolj polarne so, močnejše bodo njegove dipole-dipolo sile; In zato bo težje ločiti njihove molekule.
HF je bolj polaren kot HCl, zato je vrelišče HF nadrejena (19.5 ° C) do HCl (-85.05 ° C). Neverjetno je učinek, ki ga imajo medmolekularne sile na fizikalne lastnosti. Najmanjša variacija in snov se bo obnašala popolnoma drugačna od pričakovanih.
Vam lahko služi: plinasta država: značilnosti, splošni zakon, primeriInducirani dipolo-dipolo (Debye)
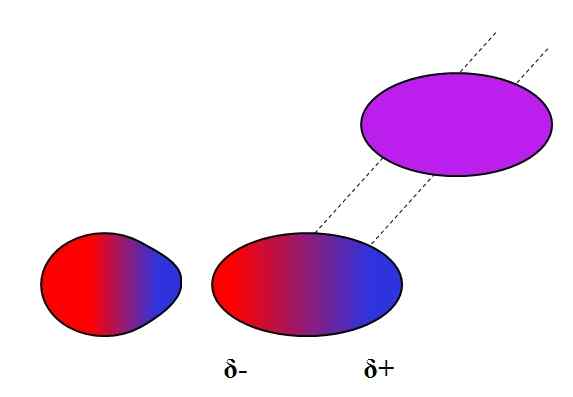 Inducirani dipolo-dipolo. Vir: Gabriel Bolívar.
Inducirani dipolo-dipolo. Vir: Gabriel Bolívar. Dipolos, tako kot ioni, lahko tudi niha ali vpliva na elektronsko porazdelitev nevtralnih atomov ali molekul. Tako na vrhunski sliki vidimo, da dipol nenadoma polarizira nevtralno molekulo. Zato se reče, da gre.
Na primer, voda lahko raztopi majhno količino oz2, Toda dovolj, da morska favna diha. Če h2Ali ne bi mogel spodbuditi dipola v O2, Ves kisik morja bi se izognil površini, ker med obema molekulama ne bi bilo interakcij.
Instant Dipolo-induciran Dipolo (London)
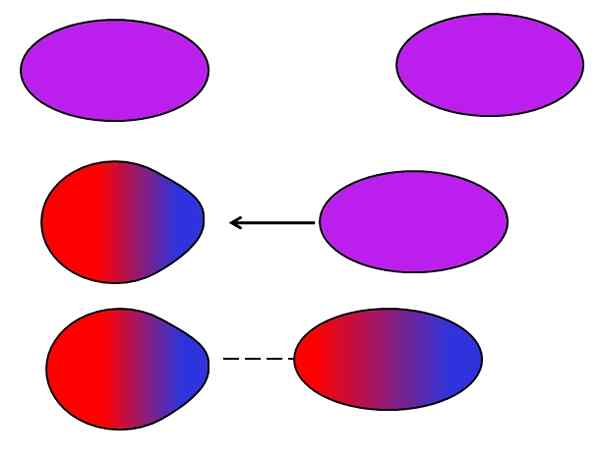 Londonske sile. Vir: Gabriel Bolívar.
Londonske sile. Vir: Gabriel Bolívar. Nevtralni atomi ali molekule ne potrebujejo sosednjih ionov ali dipolov, da bi trpeli zaradi nihanj pri porazdelitvi njihovih notranjih obremenitev. Elektroni še niso, ampak se premikajo po celotni molekuli. V nekem trenutku bo potekal takojšen dipol, ki bo v njih, če je zelo blizu nevtralne molekule ali atoma, sprožil dipol (glej zgoraj).
Večje in asimetrične te molekule, večja je verjetnost, da se bodo pojavili takojšnji dipoli. Zato imajo spojine najvišjih atomskih mas inducirane intenzivnejše dipolske sile. Ta vrsta sil Van der Waals je bolj znana kot londonske sile.
Na primer, plemeniti plini (He, NE, AR itd.) Zahvaljujoč londonskim silam ostanejo združeni, tako kot zračni plini (ali2, N2, Co2, itd.). Tudi ta sila je najbolj prevladujoča med ogljikovodiki, kot so metan, Cho4, In propane, cho3Pogl2Pogl3.
Hidrofobne sile
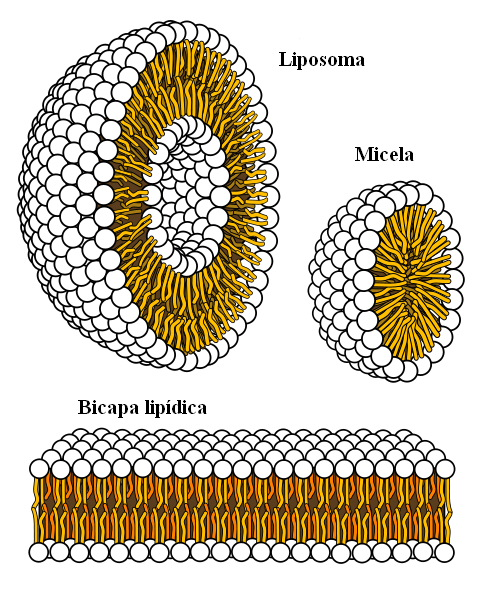 Supramolekularne strukture izvirajo iz hidrofobnih sil
Supramolekularne strukture izvirajo iz hidrofobnih sil Končno imamo hidrofobne sile, ki so poseben rezultat londonskih sil in odbojnosti med snovmi z različnimi polarnostmi. Maščobe so malo povezane z vodo, zato je pri tem netopno.
Molekule maščob se želijo združiti tako, da so njihove interakcije z vodo čim več, kar uspe oblikovati 3D strukture, kot so prikazane zgoraj.
Tako se molekule maščob, kot so fosfolipidi, združijo, da tvorijo lipidne dvosloje, micele in liposome.
Če jih opazimo, imajo te molekule belo glavo, ki predstavlja polarni del, povezan z vodo; pa tudi apolarni rep, ki odbija molekule vode. Linije se želijo postaviti v te supramolekularne strukture, tako da ne sodelujejo z vodo.

