Oborina

- 4893
- 193
- Raymond Moen
Pojasnjujemo, kaj je oborina, reakcija padavin, vrste, ki obstajajo, in dajejo več primerov
 RUNALNA OBRITAJA NASTAVITEV pri mešanju raztopine z oborinim sredstvom
RUNALNA OBRITAJA NASTAVITEV pri mešanju raztopine z oborinim sredstvom Kaj je oborina?
A oborina To je trdna snov, ki nastane iz raztopine, bodisi s kristalizacijo raztopljene snovi bodisi s tvorbo netopne snovi skozi kemično reakcijo.
Prvi primer se pojavi, ko trdna snov, ki je bila sprva raztopljena v topilu, kot voda, postane manj topna. To se lahko zgodi, ko:
- Temperatura raztopine se zniža.
- Dodano je oborilno sredstvo.
- Doda se še eno topilo, v katerem je trdna snov manj topna.
Ko njena topnost postane manjša od koncentracije, raztopina postane prenasičena in pride do reakcije padavin.
Drugi primer se pojavi po kakršni koli kemični reakciji, ki ustvari netopni ali zelo malo topni produkt v topilu. Ko se ta izdelek začne oblikovati, se rešitev hitro nasiči in trdna snov začne oboriti.
Reakcija kemičnih padavin
Reakcija padavin je kemični postopek, ki vodi do tvorbe oborine. Odvisno od nastajanja oborine lahko reakcijo zapišemo na dva različna načina:
- Če se padavine pojavijo, ker se je topnost trdne snovi v topilu zmanjšala (hlajenje ali dodajanje drugega topila, na primer), potem reakcija padavin vključuje samo topilo in bi bila videti tako:

Na primer, Če se natrijev acetat raztopi (ch-3Žep) v vroči vodi in nato pusti, da se ohladi, natrijev acetat bo oboril v skladu z naslednjo enačbo:

- Če se padavine pojavijo, ker smo dodali oborilno sredstvo, potem bo reakcija padavin vključevala tako topno kot tudi oborilno sredstvo.
Na primer, Srebrni ioni (AG+) Lahko se oborijo iz raztopine srebrnega nitrata (Agno3) Dodajanje raztopine natrijevega klorida ali NACL (oborilno sredstvo). Reakcija padavin v tem primeru je podana z:
Lahko vam služi: nikelj klorid (NICL2): struktura, lastnosti, pridobivanje, uporabe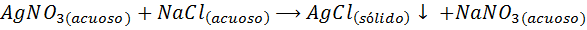
Mehanizem padavin
Ne glede na reakcijo padavin se nastajanje oborine vedno pojavi v dveh stopnjah, imenovanih nukleacija in rast:
-
Nukleacija
Na začetku reakcije padavin nastanejo majhni delci oborine, ki se imenujejo jedra, zato se ta stopnja imenuje nukleacija.
-
Rast
Po nukleaciji se novi delci ne tvorijo več, vendar jedra, ki že tvorijo, začnejo rasti, dokler se padavine ne ustavijo.
Vrste oborine
Hitrost, s katero nastanejo oborini, vpliva na velikost trdnih delcev in lastnosti istega. Odvisno od velikosti delcev in narave spojine, ki se obori, je mogoče razlikovati tri vrste oborine:
Kristalne oborine
Je najpreprostejša vrsta oborine. V tem primeru oborine sestavljajo velike trdne delce s premerom, večjim od 0,1 mikrometra.
 Kristalna oborina bakrenega sulfata (ii) pentahidrat
Kristalna oborina bakrenega sulfata (ii) pentahidrat Kristalni oborini nastanejo, ko se reakcija padavin pojavi počasi. To omogoča, da se med nukleacijo tvorijo malo trdnih delcev, vsak od teh delcev pa ima dovolj časa, da raste in tvori velike in težke kristale, ki padejo na dnu raztopine.
Ti delci so skoraj vedno kristalne trdne snovi z ravnimi in svetlimi obrazi, podobni strani diamanta in jih je mogoče skoraj vedno razlikovati s prostim očesom.
Kasezne oborine
Oborimo jih za veliko manjše delce, med 0,01 in 0,1 mikrometra premera. Ta vrsta oborine se tvori, ko se reakcija padavin pojavi zelo hitro, kar ustvari veliko delcev med nukleacijo, ki nimajo časa za rast.
Zaradi svoje velikosti so ti delci zelo lahki in so suspendirani v raztopini, ki tvorijo stabilen koloid. Zaradi tega se na dnu rešitve ne usedejo in je videti oblačno namesto prozorne.
Vam lahko služi: dihidroxyaceton: struktura, lastnosti, pridobivanje, uporabe Trije kazesovi različnih barv. Tri rešitve so mutne po nastanku oborine
Trije kazesovi različnih barv. Tri rešitve so mutne po nastanku oborine Poleg tega so delci tako majhni, da uspejo prečkati večino filtrov, ki se uporabljajo za ločevanje oborine od rešitev.
Jelery Hacords
Kadar so delci še manjši od delcev, ki so v kaselnih oborini, torej z premerom manj kot 0,01 mikrometrov, oborine imenujemo žele. Razlog je v tem, da trdna snov pridobi videz, podoben želatini ali marmeladi.
Ti oborini veljajo tudi za koloide. Pravzaprav je želatina tipičen primer koloida in ti oborini vzamejo ime po istem.
Karakteristični primeri želeja, ki so v želeju, so hidrirani oksidi nekaterih kovin. Ti oksidi absorbirajo veliko količino vode na svoji površini, kar preprečuje, da bi tvoril večje delce, ki kristalizirajo.
Primeri oborine
Natrijev acetat (ch3Žep)
Kot že omenjeno, lahko natrijev acetat oborimo iz vroče nasičene raztopine, ki se pusti ohladiti. Če se pusti, da se počasi ohladi, nastane kristalna oborina, v kateri opazimo dolge kristale bele igle.
Kadmijev sulfid (ii) (CDS)
Kadmijev sulfid je zelo netopna sol, ki jo takoj zmešamo v raztopino kadmijevega iona (II) z drugo, ki vsebuje sulfidne ione.
Bakreni sulfat (ii) pentahidrat (cuo4.5H2Da)
Ko ga raztopimo v vodi, bakreni sulfat (ii) tvori hidrirane ione intenzivne modre barve. Če voda počasi izhlapi, obori čudovite modre kristale Cuso4.5H2Tudi. Ti kristali se zdijo dragoceni kamni.
Srebrni bromid (AGBR)
To je primer spojine, ki obori, ki zelo hitro tvori oborino z zelo tankimi delci, ki jih je težko filtrirati.
Vam lahko služi: enakovredna težaAluminijev hidrirani oksid (III) (do2Tudi3.Nh2Da)
To je klasičen primer tvorbe želatinene oborine. Nastane se, ko raztopina aluminijevega nitrata (ne (ne3)3).
Mangan sulfid (ii) (MNS)
Številni sulfidi so netopni v vodi in manganov sulfid ni izjema. To obori v obliki zelo finega prahu.
Srebrni klorid (AGCL)
Srebrni ioni (i) tvorijo zelo malo topnih soli z vsemi halogeni. Primer srebrnega klorida je klasičen primer oborjene tvorbe v laboratoriju.
Kalcijev karbonat (caco3)
Kalcij je eden od ionov, ki so odgovorni za trdoto vode. Ko se voda, ki vsebuje kalcij.
Železni hidrirani oksid (iii) (vera2Tudi3.Nh2Da)
To je še en primer želatinaste oborine, ki nastane z reakcijo raztopine, ki vsebuje železne ione (III) z natrijem ali kalijevim hidroksidom.
Magnezijev hidroksid (MG (OH)2)
Magnezij je drugi kation, ki je odgovoren za trdoto vode, saj se lahko obori v obliki magnezijevega hidroksida v cevi in drugih sistemih za ogrevanje vode.
Reference
- Bancoft, w. D. (1918). Oris koloidne kemije.-Iii. Časopis Franklin Institute, 185(3), 373–387. https: // doi.org/10.1016/S0016-0032 (18) 90710-6
- Civan, f. (2007). Kristalna rast in oblikovanje obsega v poroznih medijih. Poškodba tvorbe rezervoarjev, 235-255. https: // doi.org/10.1016/B978-07506738-7/50010-5
- Skoog, d. Do., Zahod, d. M., Holler, f. J., & Crouch, s. R. (2013). Osnove analitične kemije. New York City, New York: Cengage Learning.
- Sodelavci Wikipedije. (2021, 10. januarja). Padavine (kemija). Pridobljeno iz.Wikipedija.org

