Molekularna struktura kisika, lastnosti, uporablja
- 1479
- 94
- Lee Farrell
On Molekularni kisik tudi Dioksig, Imenovan tudi diatomski ali plinasti kisik, je najpogostejša osnovna oblika, v kateri ta element najdemo na planetu Zemlja. Njegova formula je oz2, Zato je diatomska in homonuklearna molekula, popolnoma apolarna.
Zrak, ki ga dihamo, je sestavljen iz približno 21% kisika kot molekule oz2. Bolj ko se povzpnemo, koncentracije plinskega kisika se zmanjšujejo in povečajo prisotnost ozona ali3. Naše telo izkoristi O2 Da oksigenirate tkiva in izvajate celično dihanje.
 Brez obogatitve kisika bi bilo življenje v ozračju nevzdržen pojav. Vir: Pixabay.
Brez obogatitve kisika bi bilo življenje v ozračju nevzdržen pojav. Vir: Pixabay. O2 Odgovoren je tudi za obstoj ognja: brez njega bi bilo skoraj nemogoče požari in izgorevanja. To je zato, ker je njegova glavna lastnost močno oksidacijsko sredstvo, osvojitev elektronov ali zmanjšanje molekule vode ali v oksidnih anionih ali2-.
Molekularni kisik je ključnega pomena za nešteto aerobnih procesov, ki imajo uporabo v metalurgiji, medicini in čiščenju. Ta plin je praktično sinonim za toploto, dihanje, oksidacijo in na drugi strani za zamrznjene temperature, ko ima v tekočem stanju.
[TOC]
Molekularna struktura kisika
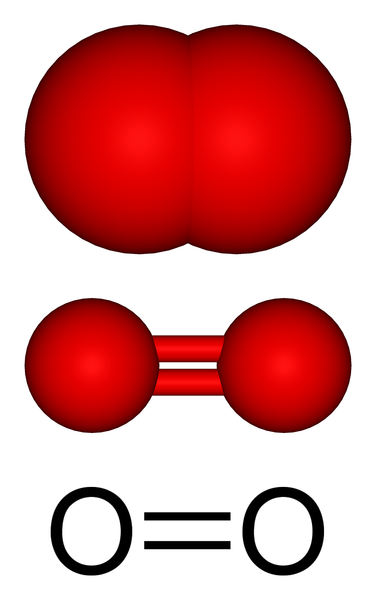
 Plinasta molekularna struktura kisika. Vir: Benjah-BMM27 prek Wikipedije.
Plinasta molekularna struktura kisika. Vir: Benjah-BMM27 prek Wikipedije. Na zgornji sliki imamo molekularno strukturo plinastega kisika, predstavljeno z več modeli. V zadnjih dveh se dokažejo značilnosti kovalentne vezi, ki ohranja atome kisika: dvojna vez o = o, v kateri vsak atom kisika dopolni svoj okte valencije.
Vam lahko služi: diastreomeriMolekula oz2 Je linearna, homonuklearna in simetrična. Njegova dvojna vez ima dolžino 121. ure. Na tej kratki razdalji je potrebna precej potrebna energija (498 kJ/mol), da prekine povezavo o = o, zato je razmeroma stabilna molekula.
Če bi bilo tako, bi se kisik atmosfere sčasoma popolnoma razgradil ali pa bi zrak zajel nič.
Lastnosti
Fizični videz
Molekularni kisik je brezbarven, brez okusa in brez vonja, toda pri kondenzaciji in kristalizaciji pridobijo modrikaste tone.
Molarna masa
32 g/mol (zaokrožena vrednost)
Tališče
-218 ° C
Vrelišče
-183
Topnost
Molekularni kisik ni zelo topen v vodi, ampak dovolj za podporo morske favne. Če bi bila vaša topnost večja, bi bilo manj verjetno, da bi umrli zaradi utopitve. Po drugi strani je njegova topnost veliko večja v oljih in apolarnih tekočinah, saj jih lahko počasi oksidira in tako vpliva na njihove prvotne lastnosti.
Energetska stanja
Molekularni kisik je snov, ki je ni mogoče v celoti opisati s teorijo povezav Valencia (TEV).
Elektronska konfiguracija kisika je naslednja:
[On] 2s² 2p⁴
Ima par manjkajočih elektronov (ali :). Ko najdeta dva kisikova atoma, sta povezana tako, da tvorijo dvojno vez o = o, in dopolnjujejo oba okteta Valencije.
Zato molekula oz2 Mora biti diamagnetna, z vsemi seznanjenimi elektroni. Vendar gre za paramagnetno molekulo in to je razloženo z diagramom njegovih molekularnih orbitalov:
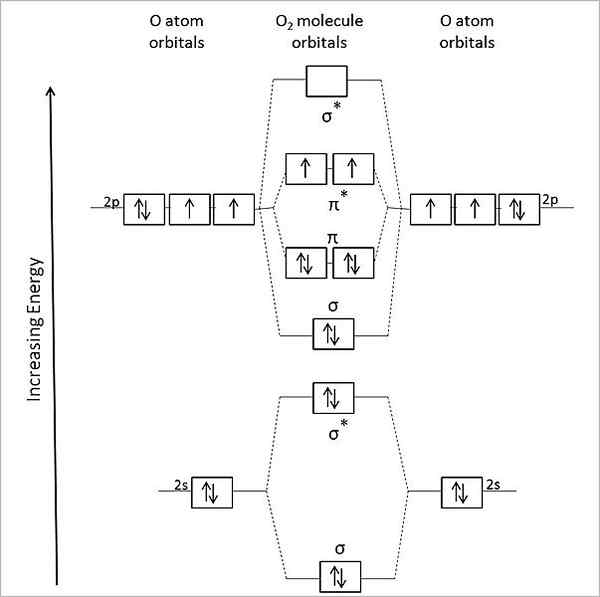 Molekularni orbitalni diagram za plinski kisik. Vir: Anthony.Sebastian/cc by-sa (https: // creativeCommons.Org/licence/by-sa/3.0
Molekularni orbitalni diagram za plinski kisik. Vir: Anthony.Sebastian/cc by-sa (https: // creativeCommons.Org/licence/by-sa/3.0 Tako molekularna orbitalna teorija (Tom) bolje opiše oz2. Dva manjkajoča elektrona sta nameščena v molekularni orbitali π*, večje energije in dajte kisik s svojim paramagnetnim značajem.
Vam lahko služi: metilamin: struktura, lastnosti, proizvodnja, uporabePravzaprav to energetsko stanje ustreza trojnemu kisiku, 3Tudi2, Najbolj prevladujoč od vseh. Drugo energijsko stanje kisika, manj obilno na zemlji, 1Tudi2.
Transformacije
Molekularni kisik je bistveno stabilen, dokler ni v stiku z nobeno snovjo, ki je dovzetna za oksidacijo, še manj, če ni tesnega vira intenzivne vročine, kot je iskrica. To je zato, ker o2 Ima veliko težnjo po zmanjšanju, pridobivanju elektronov iz drugih atomov ali molekul.
Ko se zmanjša, lahko vzpostavi širok spekter povezav in oblik. Če tvori kovalentne vezi, bo to storil z manj elektronegativnimi atomi kot on, vključno z vodikom. Lahko je tudi ogljikovo vesolje, ki povzroča vezi C-O in več vrst kisikovih organskih molekul (éteri, ketoni, aldehidi itd.).
O2 Lahko pridobite tudi elektrone za preoblikovanje v peroksidih in superoksidih, ali22- jaz2-, oziroma. Ko postane peroksid znotraj organizma, dobimo vodikov peroksid, h2Tudi2, H-O-O-H, škodljiva spojina, ki jo obdeluje z delovanjem specifičnih encimov (peroksidaze in katale).
Po drugi strani in nenazadnje O2 reagira z anorgansko snovjo, da postane oksidni anion, ali2-, Sestavljanje neskončnega seznama mineraloških mas, ki nabreknejo lubje in kopensko plašč.
Prijave
Zvari in zgorevanje
 Kisik se uporablja za zgorevanje acetilena in ogenj plamena intenzivne vročine, ki je dragocena pri zvarah. Vir: sheila/cc by (https: // creativeCommons.Org/licence/by/2.0
Kisik se uporablja za zgorevanje acetilena in ogenj plamena intenzivne vročine, ki je dragocena pri zvarah. Vir: sheila/cc by (https: // creativeCommons.Org/licence/by/2.0 Kisik se uporablja za izvajanje reakcije zgorevanja, s katero se snov eksotermično odpušča. Ta požar in njegova temperatura se razlikujeta glede na to, da gori. Tako lahko dobimo zelo vroči plameni, na primer acetilen (zgoraj), s katerimi se kovine in zlitine varijo.
Vam lahko služi: entalpijaČe ne za kisik, goriva ne bi mogla goreti in zagotoviti vso svojo kalorično energijo, ki se uporablja za odstranjevanje raket ali za zagon avtomobilov.
Oksidacijski sredstvo v zeleni kemiji
Zahvaljujoč temu plinu se sintetizirajo ali industrijsko proizvajajo neskončni organski in anorganski oksidi. Te reakcije temeljijo na oksidacijski moči molekularnega kisika, ki je tudi eden najbolj uspešnih reagentov zelene kemije za pridobivanje farmacevtskih izdelkov.
Pomoč pri dihanju in čiščenju odpadne vode
Kisik je ključnega pomena za zadovoljevanje dihalnih povpraševanja pri bolnikih z resnimi zdravstvenimi stanji, pri potapljačih, ko se spuščajo na nizkih globinah, in pri gorskih plezalcih, na višini, katerih koncentracija kisika je močno zmanjšana.
Prav tako kisik "napaja" aerobne bakterije, ki pomagajo razgraditi onesnaženje odpadkov iz odpadne vode ali pomagajo dihati ribe v vodnih pridelkih za zaščito ali trgovino.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2020). Alotropi kisika. Pridobljeno iz: v.Wikipedija.org
- Hone, c.Do., Kappe, c.Tudi. (2019). Uporaba molekularnega kisika za aerobne oksidacije tekoče faze v neprekinjenem toku. Top Curr Chem (z)377, 2. doi.org/10.1007/S41061-018-0226-Z
- Kevin Beck. (28. januar 2020). 10 uporabe za kisik. Okrevano od: Znanstvenik.com
- CliffsNotes. (2020). Biokemija I: Kemija molekularnega kisika. Okrevano od: CliffsNotes.com
- GZ Industrial Supplies. (2020). Industrijske koristi kisikovega plina. Pridobljeno iz: GZ-Supplies.com
- « Kultura portugalskih tradicij, običajev, gastronomije, religije
- Formula in enačbe destruktivne interference, primeri, vadba »

