Nitrate lastnosti, struktura, nomenklatura, usposabljanje
- 4653
- 814
- Lee Farrell
The Nitrati So vse tiste spojine, ki ne vsebujejo aniona3-, Ko gre za anorganske soli ali nitro skupino, -ono2, V primeru organskih derivatov. V anorganskem so vsi nitrati kovinske soli ali amonijev ion, v katerem prevladujejo elektrostatične interakcije mn+Ne3-.
Na primer natrijev nitrat3, Tvorijo ga ioni+ in ne3-. Ta sol, skupaj s kalijevim nitratom, kno3, so najpogostejši vzorci nitratov v naravi. Nitrati najdejo v tleh, v rastlinskih tkivih, predvsem pa v morskih in fizioloških nahajališčih, kot je Salitre, ki se nahajajo v Čilu.
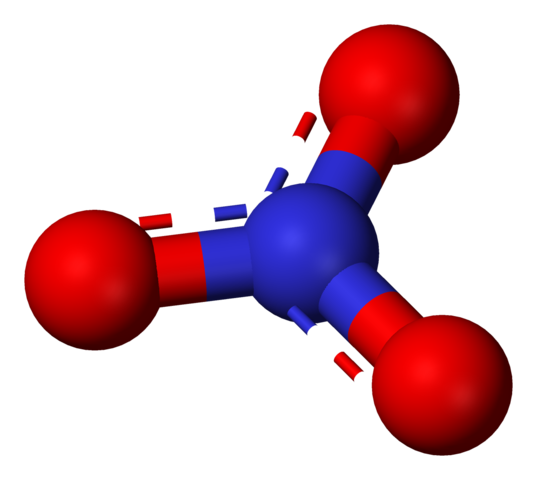
 Nitratni anion, ki ga predstavlja model sfer in palic. Vir: Benjah-BMM27 / javna domena.
Nitratni anion, ki ga predstavlja model sfer in palic. Vir: Benjah-BMM27 / javna domena. Izraz "nitrati" takoj aludira na soli, gnojila in eksplozive. Prav tako so povezani z mesom in njihovimi postopki strjevanja, da zavirajo rast bakterij in tako zamudijo njihovo poslabšanje. Nitrati so tudi sinonimi za zelenjavo, saj vsebujejo veliko količin teh soli.
On ne3- (Vrhunska slika) je najbolj oksidirana oblika dušika, ki je končni in asimiliran produkt njegovega biološkega cikla. Dušik atmosfere trpi več preobrazb, bodisi z delom električnih žarkov ali z mikrobnimi dejanji, da postane NH4+ in ne3-, tako topno v vodi in v absorbljajo rastline.
Nitrati se uporabljajo kot oksidacijska sredstva, gnojila, eksplozivi in kardiološka zdravila. Ta zadnja uporaba je v nasprotju z drugimi, saj s telesom presnavljajo ali komunicirajo tako, da razširijo žile in arterije; In zato se poveča in izboljšuje pretok krvi, lajšanje srčnih bolečin.
[TOC]
Lastnosti nitratov
Nevtralnost
Nitrati so načeloma nevtralne snovi, kot ne3- To je konjugirana baza dušikove kisline, hno3, Močna kislina. V vodi ni občutno:
Ne3- + H2Ali ⇌ hno3 + Oh-
Pravzaprav lahko rečemo, da se ta hidroliza sploh ne pojavi, količine OH so zaničevalne-. Zato so vodne raztopine nitratov nevtralne, razen če obstajajo druge raztopljene snovi.
Fizični nastopi
Anorganski nitrati so sestavljeni iz soli, katerih splošne formule so m (ne3)n, biti n To je Valencia ali pozitivna obremenitev kovinskega kationa. Vsi ti nitrati imajo kristalno svetlost in imajo belkaste barve. Vendar so lahko nitrati prehodnih kovin barviti.
Na primer, bakreni nitrat (II) ali cupric nitrat, Cu (št3)2, Je modrikasto kristalno trdno. Medtem nikelj nitrat (ii), niti (ne3)2, Je trdna smaragdna barva. Nekateri drugi nitrati, kot je železo, se predstavljajo šibke barve.
Po drugi strani so organski nitrati običajno zelo občutljivi in eksplozivni trdni snovi ali trdne snovi.
Lahko vam služi: živa snov: koncept, značilnosti in primeriToplotna razgradnja
Kovinski nitrati so občutljivi na visoke temperature, saj se začnejo razgraditi v skladu z naslednjo kemijsko enačbo:
2m (št3)2(s) → 2mo (s)+4No2(g)+oz2(g)
Kot smo opazili, se kovinski nitrat razgradi v oksid, MO in dušik in kisik dioksida. Ta toplotna razgradnja se ne pojavi pri isti temperaturi za vse nitrate; Nekateri se upirajo bolj kot drugi.
Praviloma je večja in manjša obremenitev kationa m+, Večja bo temperatura, pri kateri je treba segreti nitrat, da se razgradi. Namesto, ko m+ Je majhen ali ima veliko pozitivno obremenitev, nitrat se razgradi pri nižjih temperaturah, zato bolj nestabilno.
Na primer natrijev nitrat3, Razpade pri temperaturi, nižjo od temperature barijevega nitrata, BA (ne3)2, No, čeprav BA2+ imajo večjo obremenitev kot Na+, Njegova velikost je veliko večja.
Oksidacijsko sredstvo
On ne3- Je relativno stabilen anion. Vendar je njen dušikovi atom močno oksidiran, z oksidacijskim stanjem +5 (n5+Tudi32-), Zato je "žejna" elektronov. Zaradi tega je nitrat oksidacijsko sredstvo, ki bo skušal ugrabiti snovi elektrone okoli njega.
To je pomanjkanje elektronov v dušikovem atomu NO3- Kaj počne nano3 In kno3 močna oksidacijska sredstva, ki se uporabljajo kot komponente smodnika. Če k tej značilnosti dodamo dejstvo, da se plini sproščajo2 jaz2 Pri razpadu se razume, zakaj je del številnih eksploziva.
Ko nitrate pridobi elektrone ali zmanjša, ga lahko pretvorimo v amonijak, NH3, ali v dušikovem oksidu, ne, odvisno od reagentov in pogojev.
Topnost
Vsi anorganski nitrati ali kaj je isto, kovinski in amonijevi nitrati, NH4Ne3, So topne spojine v vodi. To je zato, ker imajo molekule vode močno afiniteto do3-, In da kristalne mreže teh nitratov niso zelo stabilne.
Struktura
Nitratni anion
 Nitratne resonančne strukture. Vir: Benjah-BMM27 / javna domena.
Nitratne resonančne strukture. Vir: Benjah-BMM27 / javna domena. Zgornja slika prikazuje resonančne strukture nitratnega aniona. Kot je razvidno, sta dva negativna naboja nameščena v dveh atomih kisika, ki sta demokalizirana med tremi atomi kisika. Zato ima vsak ali ima obremenitev -2/3, medtem ko ima dušik +1 obremenitev.
Torej, št3- Interakcija elektrostatično ali oblike koordinacijske povezave prek katerega koli od njegovih treh atomov kisika.
Trdne snovi
Vsi anorganski nitrati so slani in ionski. Zato so njegove strukture kristalne, kar pomeni, da so njeni ioni, m+ in ne3-, Urejeni so v vesolju zahvaljujoč svojim elektrostatičnim interakcijam. Odvisno od teh interakcij bodo njihovi kristali predstavili različne strukture.
Vam lahko služi: kaj je varnostni romb in za kaj je?Nano nano kristalna struktura na primer3 Je trigonalna ali romboédica, medtem ko je kno3 Je ortorrambično.
Organski nitrati
Organski nitrati so predstavljeni s splošno formulo Rono2, kjer je r alkilna ali aromatična skupina. Za te spojine je značilna njihova R-aon povezava2, in običajno sestavljeni iz dušikovih derivatov polimerov in drugih organskih snovi.
Kompleksen
On ne3- Koordinira s kovinskimi centri, da tvori povezavo m+-Ali ne2-, biti drugačna interakcija do ionske. Ti kompleksi so v bistvu anorganska narava. Nitrat je mogoče celo uskladiti z dvema atoma kisika hkrati, m+-Tudi2Ne.
Nomenklatura
Za imenovanje nitrata je treba najprej napisati besede "nitrat", ki mu sledi ime kationa ali skupina, ki ga spremlja v ustrezni kemijski formuli. Valencija kationa je določena v oklepajih, ko ima več kot eno. Prav tako se lahko uporabijo pripona -co in -oy, če so tako prednostne, po tradicionalni nomenklaturi.
Na primer razmislite o veri (ne3)3. Ime je železni nitrat (III), ker je njegova valenca +3 ali pa jo lahko imenujemo tudi železniški nitrat.
Ta pravila veljajo tudi za organske nitrate, pod pogojem, da so njihove strukture preproste. Na primer CHO3Ali ne2 Imenuje se metil nitrat, ker skupina -ch3 Postane skupina R, ki spremlja -Ono2.
Usposabljanje
Naravno
Nitrati se oblikujejo v naravi kot del biološkega cikla dušika. Zaradi tega imajo tla, morja in nekateri vodni tokovi velike količine nitratov. Glede na okoliške ione se bodo oblikovale različne soli nitratov, saj bodo nano3 In kno3 Najpogostejši in obilen.
Industrijsko
Nitrati nastajajo na industrijskih lestvicah z nevtralizacijo dušikove kisline, bodisi s kovinskimi hidroksidi, alkoholi, polimeri itd. Na primer kalcijev nitrate, CA (št3)2, Pripravimo ga lahko v skladu z naslednjo kemijsko enačbo:
CA (OH)2 + 2Hno3 → CA (št3)2 + 2H2Tudi
Podobno hno napade več organskih snovi3 pod določenimi pogoji za spodbujanje nadomestitve nekaterih njihovih skupin z -Ono2. To se zgodi z reakcijo celuloze, da se transformira v nitrocelulozo ali celulozni nitrat, polimerni in eksplozivni material.
Fotokatalitična
Anion št3-, In zato lahko anorganski nitrati tvorijo fotokatalitično delovanje odpadkov iz titanovega oksida, stric2, Uporaba kot surovina nič drugega kot dušik in zračni kisik. Ta študija predvideva, da tam, kjer obstajajo presežki2, Na voljo bodo nezaželene količine3-, ki vplivajo na pišljivost vode in lahko vključujejo alge.
Vam lahko služi: aldehidosPrijave
Ozdravitev mesa
 Klobase so eno od predelanih mesa, ki vsebuje več nitratov. Vir: pxhere.
Klobase so eno od predelanih mesa, ki vsebuje več nitratov. Vir: pxhere. Nitrati se dodajo v več mesa, zlasti klobas. Reagirajo tudi s svojimi beljakovinami, da jim dajo bolj rdečkasto barvo. Težava teh mesa je, da s kuhanjem pri visokih temperaturah proizvajajo nitrozoamine: spojine, povezane z rakom debelega črevesa.
Temu reakciji se delno izognemo, če so prisotni vitamini, kot je to primer z zelenjavo, ki čeprav je bogata z nitrati, ni povezana z rakotvornimi patologijami.
Kmetijstvo
Nitrati so topni vir dušika. Zato služi kot gnojilo za prispevanje dušika k rastlinam in tako daje prednost njihovi rasti.
Zdravilo
Nitrati imajo v telesu posebno funkcijo. Pri asimilaciji z encimskim delovanjem se zmanjša na dušikov oksid, ne. Ta molekula zavzema volumen in razširja žile in arterije, kar omogoča večji pretok krvi. Zato se nitrati uporabljajo kot zdravila za boj proti patologiji krvnega sistema.
Ironično in radovedno so bili uporabljeni organski nitrati, kot so glicerilo, nitroglicerin, izosorbidni mononitrat in pentaeritritol tetranitrat, vsi dobri kandidati v svetu eksploziva.
Eksplozivi
Nitrati se uporabljajo v eksplozivnih formulacijah, sodnik je najbolj simboličen primer. Ker so oksidacijski povzročitelji, so naklonjeni zgorevanju snovi, poleg tega, da prispevajo k nenadni širitvi volumna zaradi sproščanja plinov po razpadu.
Primeri nitratov
V prejšnjih razdelkih je bilo omenjenih več primerov nitratov. Končno bodo nekateri drugi navedeni skupaj z njihovimi formulami in imeni:
-Lanenje3: Litijev nitrat
-Rbno3: Rubidio nitrate
-Mg (št3)2: Magnezijev nitrat
-SC (št3)2: Scandio nitrat
-Cr (ne3)3: Krom nitrat (iii)
-Zn (št3)2: cink nitrat
-PB (št3)2: svinčni nitrat (ii)
-Agno3: srebrni nitrat
-Pogl3Pogl2Ali ne2: Etil nitrat
-Pogl3(Pogl2)4Ali ne2: Amilo nitrat
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Clark J. (5. junij 2019). Toplotna stabilnost nitratov in karbonatov. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Wikipedija. (2020). Nitrat. Pridobljeno iz: v.Wikipedija.org
- Angela Dowden. (12. marec 2019). Resnica o nitratih v vaši hrani. Pridobljeno iz: BBC.com
- Elsevier b.V. (2020). Nitrat. Znanstveno. Pridobljeno iz: SCINCEDIRECT.com
- Doktor. Biji s. & Prof. Govindan v. (26. aprila 2017). Vloga organskih nitratov pri optimalnem medicinskem upravljanju angine. Evropsko društvo kardiologije. Okreval od: escardio.org
- Juan, s., Chen, j., Lin, z. et al. (2013). Nastajanje nitratov iz atmosferskega dušika in kisika, fotokataliziranega z nano-scenim titanovim dioksidom. Nat commun 4, 2249. doi.org/10.1038/NCOMMS3249
- « Osnove pripovedne terapije Michaela Whitea, postopek, tehnike
- Epoksi nomenklatura, pridobivanje, aplikacije, primeri »

