Srebrna nitrat (Agno3) struktura, lastnosti, uporabe, toksičnost

- 3809
- 806
- Percy Feeney
On srebrni nitrat Je anorganska sol, katere kemijska formula je agno3. Od vseh srebrnih soli je najbolj ekonomična in tista, ki predstavlja relativno stabilnost proti sončni svetlobi, zato se manj razgradi. Je topni in nagnjen vir srebra v vsakem laboratoriju za poučevanje ali raziskovanje.
Pri poučevanju se za poučevanje reakcij padavin s srebrnim kloridom uporabljajo vodne raztopine srebrnih nitratov. Prav tako se te raztopine vzpostavijo v stik s kovinskim bakrom, da se sprosti reakcijo Rédox, v kateri se kovinsko srebro obori sredi nastalega raztapljanja bakrenega nitrata, Cu (ne3)2.
 Srebrni nitratni vzorčni zabojnik. Vir: w. Oelen/cc by-sa (https: // creativeCommons.Org/licence/by-sa/3.0
Srebrni nitratni vzorčni zabojnik. Vir: w. Oelen/cc by-sa (https: // creativeCommons.Org/licence/by-sa/3.0 Na zgornji sliki je prikazana steklenica s srebrnim nitratom. Ohranjajo ga lahko svetloba, ne da bi kmalu zatemnili kristale, produkt videza srebrnega oksida.
Po alkemičnih običajih in antibakterijskih lastnostih kovinskega srebra je bil uporabljen srebrni nitrat za razkuževanje in kavterizacijo ran. Vendar se v ta namen uporabljajo zelo razredčene vodne raztopine ali njene trdne sliva, pomešane s kalijevim nitratom, ki ga nanese konica lesenih palic.
[TOC]
Srebrna nitratna struktura
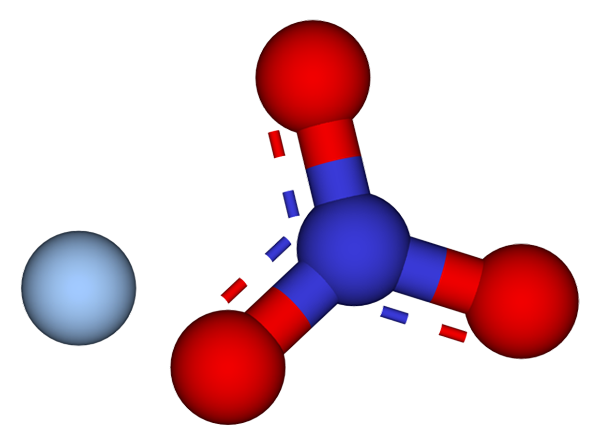 Ioni, ki sestavljajo kristale srebrnega nitrata. Vir: CCOIL/CC BY-SA (https: // CreativeCommons.Org/licence/by-sa/3.0
Ioni, ki sestavljajo kristale srebrnega nitrata. Vir: CCOIL/CC BY-SA (https: // CreativeCommons.Org/licence/by-sa/3.0 Na zgornji sliki so prikazani ioni Ag+ in ne3- srebrnega nitrata, ki ga predstavlja model sfer in palic. Formula Agno3 Označuje stehiometrični delež te soli: za vsako kation Ag+ Obstaja anion ne3- elektrostatično komuniciramo z njim.
Lahko vam služi: žveplo: zgodovina, lastnosti, struktura, pridobivanje, uporabeAnion št3- (rdeče in modrikaste sfere) ima trigonalno ravno geometrijo, pri čemer se negativna obremenitev zamaji med tremi atomi kisika. Zato potekajo elektrostatične interakcije med obema ionoma posebej med kationom Ag+ in atom kisika aniona ne3- (AG+-Ali ne2-).
Na ta način vsak Ag+ konča usklajevanje ali okoli tri3- sosednji v isti ravnini ali kristalografski plasti. Razvrstitev teh ravnin na koncu določi kristal, katerega struktura je ortorrambična.
Priprava
Srebrni nitrat se pripravi z napadom zgorelega kovinskega srebrnega kosa z dušikovo kislino, bodisi hladno ali vroče koncentrirane:
3 Ag + 4 hno3 (razredčen) → 3 agno3 + 2 h2O +ne
Ag + 2 hno3 (koncentrirano) → agno3 + H2O +ne2
Upoštevajte oblikovanje plinov ne in ne2, ki so strupeni in prisilijo te reakcije, ki se ne izvajajo zunaj zvona ekstraktorja.
Fizikalne in kemijske lastnosti
Fizični videz
Brezbarvna kristalna trdna, stranišče, a zelo grenki okus.
Molarna masa
169.872 g/mol
Tališče
209,7 ° C
Vrelišče
440 ° C. Vendar pri tej temperaturi trpi toplotno razgradnjo, v kateri se pojavlja kovinsko srebro:
2 Agno3(l) → 2 ag (s) + o2 (g) + 2 ne2 (g)
Ni agno hlapov3, Vsaj ne v kopenskih pogojih.
Topnost
Agno3 To je neverjetno topno varčevanje z vodo, ki ima topnost 256 g/ 100 ml pri 25 ° C. Topno je tudi v drugih polarnih topilih, kot so amonijak, ocetna kislina, aceton, eter in glicerol.
Gostota
4,35 g/cm3 pri 24 ° C (temperatura okolice)
Vam lahko služi: destilirana voda3,97 g/cm3 pri 210 ° C (tik na tališču)
Stabilnost
Agno3 Je stabilna snov, kadar je pravilno shranjena. Ne bo vnaprej vnesel pri nobeni temperaturi, čeprav ga je mogoče razčleniti z sproščanjem strupenih hlapov dušikovih oksidov.
Po drugi strani, čeprav srebrni nitrat ni vnetljiv, je močno oksidacijsko sredstvo, ki je, ko pride v stik z organsko snovjo in toplotnim virom, lahko sproži eksotermično in eksplozivno reakcijo.
Poleg tega te soli ne bi smeli biti izpostavljeni preveč časa sončni svetlobi, saj so njihovi kristali zatemnjeni zaradi tvorbe srebrnega oksida.
Srebrne nitrate uporablja
Oborine in analitično sredstvo
V prejšnjem razdelku je bila omenjena neverjetna topnost Agno3 V vodi. To pomeni, da Ag ioni+ Raztopili se bodo brez kakršnih koli težav in bodo na voljo za interakcijo s katerim koli vodnim srednjim ionom, kot so halogenidni anioni (x = f-, Cl-, Br- in jaz-).
Srebro kot ag+, In po dodatku hno3 razredčeni, obori fluoride, kloride, bromide in jodide, ki so sestavljeni iz belih ali rumenkastih trdnih snovi:
Ag+(ac) +x-(AC) → AGX (S)
Ta tehnika je zelo ponavljajoča se za pridobitev halogenuros in se uporablja tudi pri številnih kvantitativnih analitičnih metodah.
Cestninski reagent
Agno3 Prav tako igra analitično vlogo pri organski kemiji, saj je glavni reagent poleg amoniaka za pripravo cestninskega reagenta. Ta reagent se uporablja v kvalitativnih preskušanjih, ki omogočajo določitev prisotnosti aldehidov in ketonov v vzorcu problema.
Sinteza
Agno3 Je odličen topni vir srebrnega iona. To poleg sorodnih in nizkih stroškov naredi tudi zahtevani reagent za nešteto organske in anorganske sinteze.
Lahko vam služi: Gibbs Free Energy: enote, kako se izračuna, rešijo vajeNe glede na reakcijo, če potrebujete Ag ione+, Torej je povsem verjetno, da se kemikalije zatekajo k Agnu3.
Zdravilno
Agno3 Pred pojavom sodobnih antibiotikov je imel veliko priljubljenosti v medicini. Danes pa se še vedno uporablja za posebne primere, saj ima kavsterje in antibakterijske lastnosti.
Običajno ga mešamo s kno3 Na konici lesenih palic, tako da je rezervirana izključno za lokalne uporabe. V tem smislu je služil za zdravljenje bradavic, ran, okuženih nohtov, nosnih razjed in krvavitev. Agno mešanica3-Kno3 Cauteriza Koža, ki uničuje poškodovano tkivo in bakterije.
Baktericidno delovanje agno3 Uporablja se tudi pri čiščenju vode.
Toksičnost in neželeni učinki
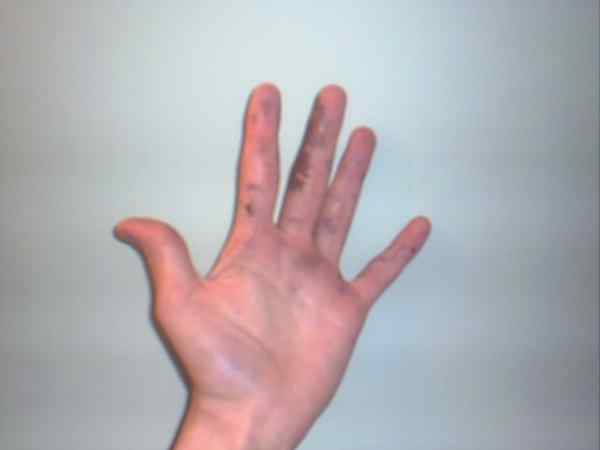 Srebrni nitrat lahko povzroči opekline, ki jih prikazujejo vijolične ali temne lise. Vir: Jane of Baden v angleški Wikipediji / javna domena
Srebrni nitrat lahko povzroči opekline, ki jih prikazujejo vijolične ali temne lise. Vir: Jane of Baden v angleški Wikipediji / javna domena Čeprav je srebrni nitrat stabilna plača in ne predstavlja preveč tveganj, je zelo kavstična trdna snov, katere zaužitje lahko povzroči hude poškodbe prebavil.
Zato se priporoča njegova manipulacija z rokavicami. Kožo lahko zažge, v nekaterih primerih pa jo zatemnite, dokler ne obrne vijolične, stanja ali bolezni, znane kot Argiria.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2020). Srebrni nitrat. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2020). Srebrni nitrat. Baza podatkov Pubchem., Cid = 24470. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Elsevier b.V. (2020). Srebrni nitrat. Znanstveno. Pridobljeno iz: SCINCEDIRECT.com
- Univerza v Iowa. (2020). Uporaba srebrnega nitrata in strupenost. Obtoženo od: zdravila.Uiowa.Edu
- Str.F. Lindley & P. Woodward. (1966). An X-Ray Research of Silver nitrat: edinstvena kovinska nitratna struktura. Journal of the Chemical Society A: anorganski, fizični, teoretični.
- Lucy Bell Young. (2020). Kakšne so medicinske uporabe srebrnega nitrata. Reagent kemikalije. Okrevano od: kemikalije.co.Združeno kraljestvo
- « Piperidina struktura, sinteza, derivati, reakcije
- C ++ Zgodovina, značilnosti, vrste podatkov, primeri »

