Značilnosti atomskega modela Thomson, postulati, subatomski delci
- 1561
- 402
- Stuart Armstrong
On Thomson Atomski model Ustvaril ga je angleško fizično slavno. J. Thomson, ki je odkril elektron. Zaradi tega odkritja in njegovih del o električni prevodnosti v plinih je bila leta 1906 podeljena z Nobelovo nagrado iz fizike.
Iz njegovega dela s katodnimi žarki je bilo razkrito, da atom ni nedeljiva entiteta, kot je Dalton postavil v prejšnjem modelu, ampak da je vseboval dobro definirano notranjo strukturo.

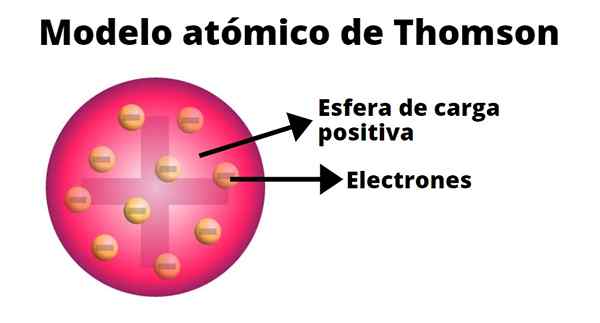
Thomson je razvil atomski model, ki temelji na rezultatih svojih poskusov s katodnimi žarki. V njem je potrdil, da je atom, električno nevtralen, oblikovan iz pozitivnih in negativnih nabojev enake velikosti.
[TOC]
Kako je bilo ime Thomsonovega atomskega modela in zakaj?
Po Thomsonovem mnenju je bila pozitivna obremenitev razporejena po celotnem atomu in v njej so bili vgrajeni negativni naboji, kot da so rozine pudinga. Iz te primerjave se je pojavil izraz "rasin puding", saj je bil model neuradno znan.
 Joseph John Thomson
Joseph John Thomson Medtem ko je Thomsonova ideja trenutno precej primitivna, za svoj čas je predstavljal nov prispevek. Med kratko veljavnostjo modela (od leta 1904 do 1910) je imel podporo številnim znanstvenikom, čeprav so mnogi drugi menili.
Končno so se leta 1910 pojavili novi dokazi o atomski strukturi in Thomsonov model so hitro ostali na strani. To se je zgodilo takoj, ko je Rutherford objavil rezultate svojih disperzijskih poskusov, ki so pokazali obstoj atomskega jedra.
Vendar je Thomsonov model prvi, ki je postavil obstoj subatomskih delcev in njihovi rezultati so bili plod drobnega in strogega eksperimentiranja. Na ta način je vzpostavil precedens za vsa odkritja, ki so sledila.
Značilnosti in postulati modela Thomson
Thomson je prišel do svojega atomskega modela na podlagi več opazovanj. Prva je bila, da so X -RAYS, ki ga je na novo odkril Roentgen, lahko ionizirali molekule zraka. Do takrat je bil edini način za ionizacijo kemično ločevanje ionov v raztopino.
Toda angleški fizik uspešno ionizira celo monoatomske pline, kot je helij, skozi x -roys. To ga je pripeljalo do prepričanja, da je lahko obremenitev znotraj atoma ločena in da zato ni nedeljiva.Opazil je tudi, da lahko katodne žarke preusmerijo z električnimi in magnetnimi polji.
 J.J. Thomson, odkrivalec elektrona. Vir: Lafer.
J.J. Thomson, odkrivalec elektrona. Vir: Lafer. Nato je Thomson zasnoval model, ki je pravilno razložil dejstvo, da je atom električno nevtralen in da so katodni žarki sestavljeni iz delcev z negativno obremenitvijo.
Pregled eksperimentalnih dokazov je Thomson atom označil za naslednji:
-Atom je električno nevtralna trdna krogla, s približnim polmerom 10-10 m.
-Pozitivno obremenitev bolj ali manj enakomerno porazdeli s kroglico.
-Atom vsebuje "truplo", naložene negativno, ki zagotavljajo njihovo nevtralnost.
-Ti truplo so enaki za vse snovi.
-Ko je atom v ravnovesju, obstaja n Corpuscles, ki so redno razporejeni v obroči znotraj sfere pozitivne obremenitve.
-Masa atoma je enakomerno razporejena.
Katodni žarki
 Elektronski žarek je usmerjen od katode do anode.
Elektronski žarek je usmerjen od katode do anode. Thomson je svoje poskuse izvedel s katodnimi žarki, odkrit leta 1859. Katodni žarki so negativno nabiti delci. Za proizvodnjo se uporabljajo vakuumske kristalne cevi, v katerih sta nameščena dve elektrodi, imenovani, imenovani katoda in anoda.
Vam lahko služi: magnetizem: magnetne lastnosti materialov, uporabeNato se prenese električni tok, ki segreva katodo, ki tako oddaja nevidno sevanje, ki je usmerjeno neposredno na nasprotno elektrodo.
Za odkrivanje sevanja, ki ni nič drugega kot katodni žarki, je stena cevi prekrita s fluorescentnim materialom. Ko tja pride sevanje, stena cevi oddaja intenzivno svetilnost.
Če je trden objekt nameščen na poti katodnih žarkov, vrže senco na steno cevi. To kaže, da žarki potujejo v ravni črti in tudi, da jih zlahka blokirajo.
O naravi katodnih žarkov je bila široko razpravljana, saj je bila njena narava neznana. Nekateri so mislili, da gre za elektromagnetne valove, medtem ko so drugi trdili, da gre za delce.
Subatomski delci Thomson Atomski model
Thomsonov atomski model je, kot smo rekli, prvi, ki je postavil obstoj subatomskih delcev. Thomsonovi telesni korpuscli niso nič drugega kot elektroni, temeljni delci negativno obremenjenega atoma.
Trenutno vemo, da sta druga dva temeljna delca proton, pozitivno naložena in nevtrona brez obremenitve.
Toda te takrat niso odkrili Thomson. Pozitiven naboj v atomu je bil razdeljen vanj, ni upošteval nobenega delca, ki bi prenašali omenjeni obremenitev, in trenutno ni bilo dokazov o njegovem obstoju.
Zaradi tega je imel njegov model minljiv obstoj, saj so v nekaj letih Rutherfordovi disperzijski poskusi odprli pot za odkritje protona. In kar se tiče nevtrona, je sam Rutherford predlagal svoj obstoj nekaj let, preden so ga končno odkrili.
Cev Crookes
Sir William Crookes (1832-1919) je zasnoval cev, ki nosi njegovo ime okoli leta 1870, z namenom, da natančno preuči naravo katodnih žarkov. Dodal je električna polja in magnetna polja in opazil, da so jih žarki preusmerili.
 Shema cevi katode. Vir: vitez, r.
Shema cevi katode. Vir: vitez, r. Na ta način so Crookes in drugi raziskovalci, vključno s Thomsonom, ugotovili:
- V notranjosti cevi katodne žarke je bil ustvarjen električni tok
- Žarki so odstopali s prisotnostjo magnetnih polj, enako kot negativno nabiti delci.
- Vsaka kovina, ki se uporablja za izdelavo katode, je bila enako dobro za proizvodnjo katodnih žarkov, njihovo vedenje pa je bilo neodvisno od materiala.
Ta opažanja so spodbudila razpravo okoli izvora katodnih žarkov. Tisti, ki so trdili, da so valovi, temeljijo na dejstvu, da lahko katodni žarki potujejo po ravni črti. Poleg tega je ta hipoteza zelo dobro razložila senco, da je prepleteni trdni predmet vrgel na steno cevi in v določenih okoliščinah je bilo znano, da lahko valovi povzročijo fluorescenco.
Toda namesto tega ni bilo razumeno, kako je mogoče, da so magnetna polja preusmerila katodne žarke. To je imelo le razlago, če so bili ti žarki obravnavani kot delci, hipoteza, ki jo je delil Thomson.
Delci, naloženi v enakomerna električna in magnetna polja
Delec, napolnjen z obremenitvijo Q, doživi verno silo na sredini enotnega električnega polja in velikosti:
Vam lahko služi: valovita teorija svetlobe: razlaga, aplikacije, primeriVera = qe
Ko naloženi delček pravokotno prečka enakomerno električno polje, kot je tisto, ki se pojavi med dvema ploščama z nasprotnimi obremenitvami, doživi odstopanje in zato pospešek:
qe = ma
a = qe/m
Po drugi strani pa se na sredini enotnega magnetnega polja z magnetnim poljem B premika z magneto magnetnim poljem B, ima magnetno silo FM, ki ga doživlja, naslednjo intenzivnost:
Fm = qvb
Dokler so vektorji hitrosti in magnetnega polja pravokotni. Ko naložen delček vpliva pravokotno v homogenem magnetnem polju, doživi tudi odstopanje in njegovo gibanje je enakomerno krožno.
Centripetalni pospešek doc V tem primeru je:
Qvb = mac
Povsem pospeševanje centripetalnega pospeška je povezano s hitrostjo delcev V in polmerom r krožne poti:
doc = v2/R
Zato:
Qvb = mv2/R
Polmer krožne poti je mogoče izračunati na naslednji način:
R = mv/qb
Kasneje bodo te enačbe uporabljene za poustvarjanje načina, kako je Thomson sklepal razmerje med elektronsko obremenitvijo-Mandy.
Thomsonov eksperiment
Thomson je prehodil žarek katodnih žarkov, elektronov, čeprav še vedno ni vedel skozi enotna električna polja. Ta polja so ustvarjena med dvema prevodnima ploščama, naloženih in ločenih na majhni razdalji.
Tudi katodni žarki so šli skozi enakomerno magnetno polje in opazovali učinek, ki ga je imel to na žarek. Tako na enem polju kot drugem je bil v žarkih odklon, zaradi česar je Thomson pravilno razmišljal, da je žarek sestavljen iz nabitih delcev.
Za preverjanje je Thomson izvedel več strategij s katodnimi žarki:
- Spremenite električna in magnetna polja, dokler sile niso preklicane. Na ta način so katodni žarki šli skozi, ne da bi eksperimentirali odklon. Ujemanje električnih in magnetnih sil je Thomsonu uspelo določiti hitrost delcev žarka.
- Razveljavil intenzivnost električnega polja, na ta način so delci sledili krožni poti na sredini magnetnega polja.
- Kombinirali rezultate korakov 1 in 2, da smo določili razmerje med obremenitvijo mand v "telesu".
Razmerje z elektronskim tovornim masom
Thomson je ugotovil, da ima tovorno mand razmerje delcev, ki so sestavljali katodni žarki, naslednjo vrednost:
Q/m = 1.758820 x 10 11 c.kg-1.
Kjer q predstavlja obremenitev "corpuscle", ki je pravzaprav elektron in m Je masa istega. Thomson je sledil postopku, opisanem v prejšnjem razdelku, ki ga tukaj poustvarimo korak za korakom, z enačbami, ki jih je uporabil.
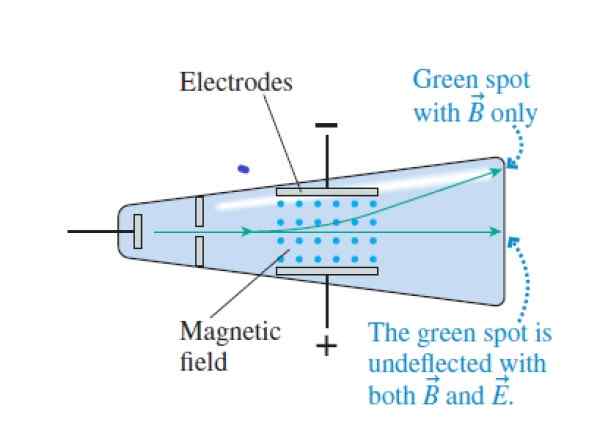 Ko so katodni žarki prečkali križno in magnetno polja, prehajajo brez odklona. Ko je električno polje preklicano, vplivajo na vrh cevi (magnetno polje je označeno z modrimi točkami med elektrodami). Vir: vitez, r.
Ko so katodni žarki prečkali križno in magnetno polja, prehajajo brez odklona. Ko je električno polje preklicano, vplivajo na vrh cevi (magnetno polje je označeno z modrimi točkami med elektrodami). Vir: vitez, r. Korak 1
Ujemajte se z električno in magnetno silo, ki prehaja žarek skozi pravokotna električna in magnetna polja:
Qvb = qe
2. korak
Določite hitrost, ki jo prinašajo delci žarka, ko prehajajo neposredno brez odklona:
V = e/b
Korak 3
Prekliči električno polje in pusti samo magnetno polje (zdaj je odklon):
R = mv/qb
Z v = e/b rezultati:
R = jaz/qb2
Polmer orbite je torej mogoče izmeriti:
Q/m = v/rb
O No:
Q/m = e/rb2
Naslednji koraki
Naslednja stvar, ki jo je storil Thomson, je bilo meriti količnik Q/m z uporabo katod iz različnih materialov. Kot je navedeno zgoraj, so vse kovine oddajale katodne žarke z enakimi lastnostmi.
Vam lahko služi: induktivna reakcijaNato je Thomson primerjal svoje vrednosti z vrednostmi Q/M razmerja vodikovega iona, pridobljenega z elektrolizo in katerih vrednost je približno 1 x 108 C/kg. Quostient Electron obremenitve-masa je približno 1750-krat večji od vodikovega iona.
Zato so imeli katodni žarki veliko večjo obremenitev ali morda maso, veliko manjšo od vodikovega iona. Vodikov ion je preprosto proton, katerega obstoj je bil znan čas po Rutherfordovih disperzijskih poskusih.
Danes je znano, da je proton skoraj 1800 -krat bolj masiven od elektrona in z obremenitvijo enake razsežnosti in znakov v nasprotju z elektronom.
Druga pomembna podrobnost je, da s Thomsonovimi poskusi električni naboj elektrona ni bil določen niti vrednost njegove mase ločeno. Te vrednosti so bile določene z Millikanovimi poskusi, ki so se začeli leta 1906.
Thomson in Dalton modelira razlike
Temeljna razlika teh dveh modelov je, da je Dalton mislil, da je atom sfera. V nasprotju s Thomsonom ni predlagal obstoja pozitivnih ali negativnih obtožb. Za Dalton je bil atom tak:
 Dalton Atom
Dalton Atom Kot smo že videli, je Thomson menil, da je atom deljiv in katere strukturo tvori pozitivna krogla in elektroni naokoli.
Napake in omejitve modela
Takrat je Thomsonov atomski model uspelo zelo dobro razložiti kemično obnašanje snovi. Prav tako je upravičeno razložil pojave, ki so se zgodili v cevi Cathode Ray.
Toda v resnici Thomson sploh ni poklical svojih "elektronov" delcev, čeprav je izraz že že skoval George Johnstone Stoney. Thomson jih je preprosto poimenoval "Corpuscles".
Čeprav je Thomson izkoristil vse znanje, ki ga je zaenkrat imel, je v njegovem modelu več pomembnih omejitev, ki so bile kmalu očitne:
-Pozitivna obremenitev ni razporejena po vsem atomu. Rutherfordovi disperzijski poskusi so pokazali, da je pozitivna obremenitev atoma nujno omejena na majhno območje, ki je kasneje postalo znano kot Atomsko jedro.
-Elektroni imajo v vsakem atomu določeno porazdelitev. Elektroni niso enakomerno razporejeni, kot so rozine slavnega prijatelja, ampak imajo na razpolago v orbitalah, ki so jih pokazali naslednji modeli.
Prav razporeditev elektronov znotraj atoma omogoča organiziranje elementov za njihove značilnosti in lastnosti v periodični tabeli. To je bila pomembna omejitev modela Thomson, ki ni mogel razložiti, kako je bilo mogoče na ta način naročiti elemente.
-Atomsko jedro je tisto, ki vsebuje večino testa. Thomsonov model je postavil, da je bila masa atoma enakomerno razporejena v notranjosti. Toda danes vemo, da je masa atoma praktično koncentrirana v protonih in nevtronih jedra.
Pomembno je tudi poudariti, da ta atomski model ni omogočil sklepanja o vrsti gibanja, ki so ga imeli elektroni znotraj atoma.
Zanimivi članki
Schrödinger Atomski model.
Broglie Atomski model.
Chadwick Atomski model.
Heisenberg Atomski model.
Perrin atomski model.
Dalton Atomski model.
Atomski model Dirac Jordan.
Atomski model Demokrita.
Atomski model Leucipo.
Atomski model Bohr.
Sommerfeld Atomski model.
Trenutni atomski model.
Reference
- Andriessen, m. 2001. Tečaj HSC. Fizika 2. Jacaranda HSC Science.
- Arfken, g. 1984. Univerzitetna fizika. Akademski tisk.
- Vitez, r. 2017. Fizika za znanstvenike in inženiring: strateški pristop. Pearson.
- Rex, a. 2011. Osnove fizike. Pearson.
- Wikipedija. Thomson Atomski model. Okrevano od: je.Wikipedija.org.
- « Splošne formule kvadratne enačbe, primeri, vaje
- Aomični model značilnosti in postulatov Dirac jordana »

