Hydronio ion
- 836
- 229
- Lee Farrell
Kaj je hidronijev ion?
On Hydronio ion To je nekakšna pozitivna obremenitev, ki je posledica protonacije molekule vode in katerih kemična formula je H3Tudi+. Sestavljen je iz najpreprostejših Oxonov: ioni, kjer kisik nosi pozitivno formalno obremenitev in ima tri kovalentne vezi.
H3Tudi+ Je eden najpreprostejših, a radovednih kationov. V vodi v normalnih pogojih ima koncentracijo 1,10-7 M, produkt samo -ravnovesja. Vendar se njegova koncentracija poveča eksponentno, ko je močna3Tudi+ Se raztopijo v vodi in jo zakisajo.
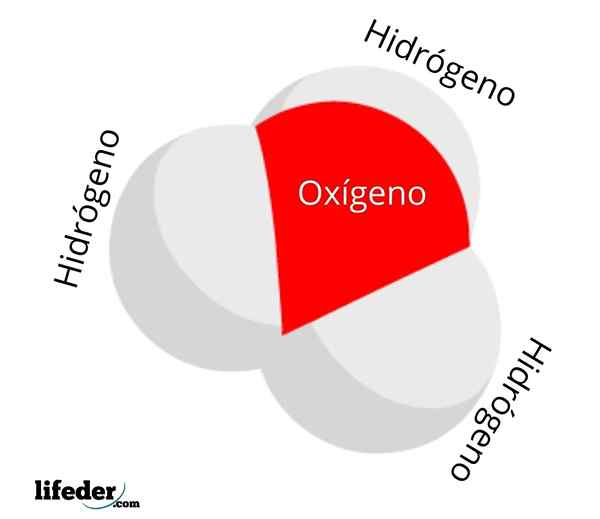
 Molekula hidronijevega iona
Molekula hidronijevega iona Koncentracija ali aktivnost h3Tudi+ V vodi služi za merjenje kislosti vodnih raztopin: ph. Več h ionov3Tudi+ Seno, manj pozitiven bo pH in več kislin bo zadevna rešitev. Ta kislost po drugi strani leži v vodikovem ionu, h+, ki je pogosto zmedena z ionom h3Tudi+.
 Formula ionske ali hidronio
Formula ionske ali hidronio H+ in njegova neverjetna sposobnost prenosa med vodikovimi mostovi molekul voda omogoča H3Tudi+ povezovanje v bolj zapletenih kationskih formacijah; kot je Eigenov kation, h9Tudi4+, in Zundelov kation, h5Tudi2+, in mnogi drugi.
Hydronijeva ionska struktura
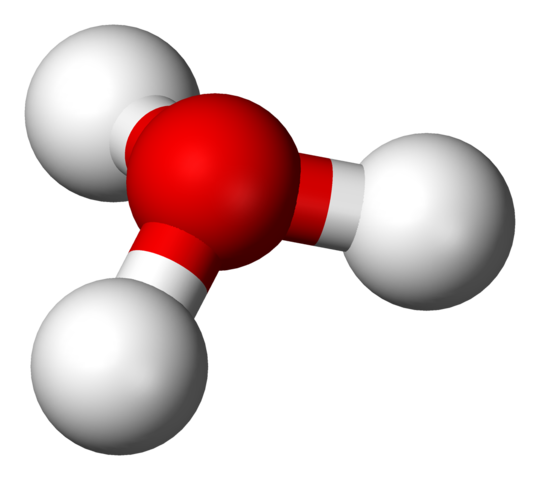 H3O+ struktura z modelom kroglic in palic
H3O+ struktura z modelom kroglic in palic Na prvi sliki ste lahko videli strukturno formulo hidrium iona. Zdaj vidimo njegovo reprezentacijo z modelom sfere in palic. V obeh poudarkih je trigonalna piramidna geometrija, katere koti vezi (O-H) so 113 °; Malo preusmerjeno s 119 ° za tetraedron.
Čeprav ima kisik pozitivno delno obremenitev, to ne pomeni, da je negativno območje okoli vodikovih atomov. Nasprotno. Kisik v h3Tudi+ Še bolj elektronegativni produkt njegovega elektronskega pomanjkanja; Torej vsa negativna gostota vizualizirana na elektrostatičnem potencialnem zemljevidu:
Vam lahko služi: kalijev sulfat (K2SO4): struktura, lastnosti, uporabe, sinteza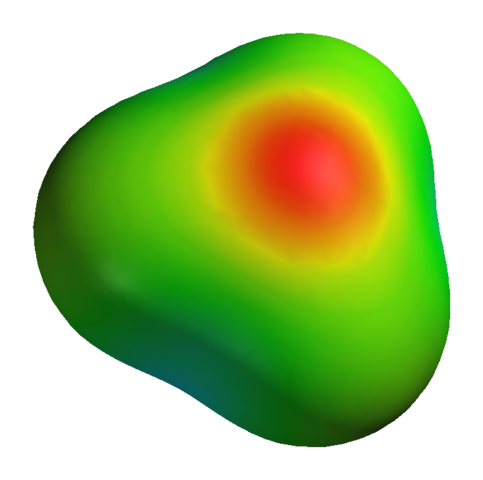 Zemljevid elektrostatičnega potenciala za H3O+
Zemljevid elektrostatičnega potenciala za H3O+ Da ne omenjam, da ima kisik nekaj prostih elektronov, kar krepi še več negativne gostote.
Posledica vsega zgoraj navedenega je, da je H vodiki3Tudi+ Izgubijo elektronsko gostoto, ker jo kisik privlači k sebi. Zato h3Tudi+ Lahko vzpostavite zelo močne vire vodika s sosednjo molekulo vode: H2Tudi+-H-oh2.
Ta interakcija je ključ za neverjetno ionsko mobilnost H+ in zakaj h3Tudi+ Se lahko hkrati poveže s številnimi molekulami vode.
Kislost
Hydronio ion je zelo močna kislina. Pravzaprav je najmočnejša kislina, ki lahko obstaja v vodni raztopini. Ker? Ker bo katera koli druga kislina, močnejša od njega3Tudi+:
Ha + h2O → a- + H3Tudi+
H3Tudi+ Lahko ostane stabilen, kadar v okolju ni drugih baz, ki so močnejše od vode. Vsaka kislina, ki jo je to izpolnila, bo uvrščena med močna kislina. Medtem, če je kislina šibkejša od H3Tudi+, Potem del HA ne bo popolnoma disociiran in govorili bomo o šibki kislini:
Ha + h2Ali ⇌ a- + H3Tudi+
Zato od h3Tudi+ To je najmočnejša kislina, ki obstaja v vodi, kislost tega bo odvisna od koncentracije H3Tudi+. To je osnova za preprosto opredelitev kislosti vodne raztopine, izražene kot pH:
pH = -log [h3Tudi+]
H+ VS. H3Tudi+
Vodikov ion in hidronium nista enaka. H+ Je veliko bolj kislo kot h3Tudi+, No, sestavljen iz protona nič več, kar bo iskalo molekulo, da bi na vse načine pridobili elektrone. Ko h+ Pridobite obliko molekule vode h3Tudi+:
Lahko vam služi: cupric oksid (cuo)H+ + H2O → h3Tudi+
Zato h3Tudi+ lahko predstavljamo kot h+(Ac), kar kaže, da je h+ V vodnem mediju.
Sila kisline se meri v njegovi sposobnosti darovanja, v skladu z definicijo Brönsted-Lowry, H ionov+. Koliko močnejše je, bolj bo daroval+, Brez h3Tudi+. Najmočnejše kisline, ki so jih kdaj sintetizirali (supercidi), so tiste, kjer h+ Je "gol"; torej brez ovire, da bi skočili proti molekuli, ki bo protonirala.
Praksa zastopanja h3Tudi+ kot h+(AC) Tako pogosto je, da se velikokrat govorimo o obeh, kot da bi bila enaka, ne da bi negativno vplivali na razlago kemije rešitev.
Solvacija
H3Tudi+ Lahko tvori zelo močne vodikove mostove s sosednjo molekulo vode. Pri tem imamo kation Zundel, h5Tudi2+:
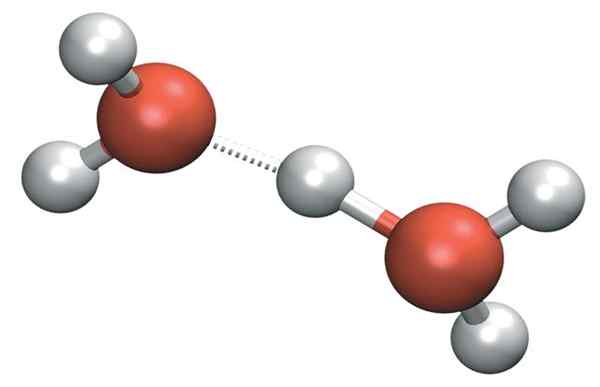 Zundel kation
Zundel kation Toda pozitivna obremenitev ne ostane samo na eni strani kationa: to se lahko prenese na drugo molekulo vode, kot je Ion H+:
H2O- h-+Oh2 → H2Tudi+-H- oh2
Zato se pozitivna obremenitev porazdeli med obe kisikovi atomi za obe molekuli vode.
V primeru lastne katione, h9Tudi4+, a h3Tudi+ tvorijo vodikove mostove s tremi molekulami vode, med njimi pa razdelijo pozitivno obremenitev zahvaljujoč "skoku" h+. Ti skoki so tako hitri, da pojasnjujejo veliko ionsko mobilnost H+ V vodi, z uporabo h3Tudi+ kot vozilo in molekule vode kot avtocesta.
H5Tudi2+ in h9Tudi4+ Niso edina kationska združenja, ki h3Tudi+ lahko izvira iz vode. Nekateri izračuni molekularne dinamike kažejo na obstoj H grozda3Tudi+(H2Da)dvajset: 20 h molekul2Ali interakcijo s H kationom3Tudi+ in med njimi razdeli pozitivno obremenitev.
Vam lahko služi: neodimij: struktura, lastnosti, uporabeZato h3Tudi+ in h+ Zgradijo radoveden odnos z molekulami vode, onkraj kislosti.
Greš ven
Tako kot obstajajo organske oksije. Njegova splošna formula je [H3Tudi+] [X-], Kjer x- Je vsak anion, ki izhaja iz raztapljanja zelo močne kisline.
Te soli včasih prejmejo ime "monohidratne kisline", saj formula [h3Tudi+] [X-] ali h3Tudi+· X- Lahko ga zapišemo tudi kot hx · h2Tudi. Tako lahko obstajajo dihidratne kisline, hx · 2h2Ali, trihidrate, hx · 3h2Ali itd.
Na primer, HCl lahko kristalizira kot HCl · H2O h3Tudi+· Cl-. Imamo tudi druge hidronijeve soli, kot je H3Tudi+· CLO4- ali hclo4· H2Ali, in hbr · 4h2O h3Tudi+· Br-· 3H2Tudi.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Kemija InorgánICA. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2020). Hidronij. Pridobljeno iz: v.Wikipedija.org
- AVNEET Kahlon in Stephen Spodnji. (15. avgust 2020). Hidronijev ion. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Čelada, Anne Marie, ph.D. (25. avgust 2020). Opredelitev hidronijevega iona. Okreval od: Thoughtco.com
- Uredniki Enyclopeedia Britannica. (2020). Vodikov ion. Okrevano od: Britannica.com

