Kemična vztrajnost

- 3297
- 62
- Percy Feeney
Kaj je kemična inercija?
Kemična inercija je lastnost, ki ima snov ali material, ki vzdrži razgradnjo, ki jo povzročajo zunanja sredstva. V tem smislu njegove fizikalne lastnosti in zlasti kemikalije ostanejo nespremenjene. Ni nobenih prekinitev povezave ali oblikovanja novih.
Zdaj je kemična inercija relativna. Nekatere snovi ali materiali so bolj inertne kot druge, kar je posledica narave in moči njihovih interakcij. Kot je bilo načeloma, v nasprotju s pojavi sprememb, ki se lahko razvijajo v različnih izdelkih, ki se lahko razvijajo.
 Zlato pokukanje. Zlato je korozija bolj odporna kovina
Zlato pokukanje. Zlato je korozija bolj odporna kovina Zato, vendar inerten, da gre za snov ali material, bo vedno obstajal pogoj, pod katerim postane reaktiven. Na primer, zlato je najplemenitejše kovine in se šteje za inertno. Vendar ga napade in raztopi z kraljevsko vodo, raztopino, do katere je zelo reaktivna.
Morda in do danes je edini kemični element, ki je pokazal absolutno kemično inercijo, neonski. Nobena spojina ni znana, niti v pogojih ultrapremira, kot so tisti v jedrih planetov ali lun.
Značilnosti kemične vztrajnosti
Pomanjkanje oksidacije
Da bi bil material ali snov inerten, načeloma ne sme reagirati z okoliškim zrakom. To pomeni, da ne tvori povezav z molekulami kisika ali dušika, ki obkrožajo njegovo površino. Z drugimi besedami: ne oksidirajte izpostavljenosti zraku.
Hrana in vse zadevne ekološke snovi ponavadi oksidira. Zato se reče, da niso inertni.
Pomanjkanje oksidacije pri kemični vztrajnosti je treba vzdrževati pri temperaturah, višjih od 100 ° C. Višja kot je temperatura, snovi ali materiali se bodo začele hitreje oksidirati, reagirali s kisikom ali dušikom zraka, da tvorijo okside oziroma nituros.
Kislinska odpornost ali alkalije
Druga značilnost, ki je prisotna v kemični inerciji, je odpornost na kisline ali baze. To pomeni, da bi se morala inertna snov ali material upreti napadu kislin, ne da bi se s sprejemanjem H ionov razgradili+ ali zelo močne elektrofile; ali napad baz, ne da bi se poslabšal zaradi ionov OH-.
Lahko vam služi: perbromska kislina (Hbro4): Lastnosti, tveganja in uporabeSpet je to relativno, saj obstajajo različne vrste kislin in baz. Nekatere inertne snovi so lahko zelo odporne na, recimo žveplove kisline, vendar se razgradijo namesto spodnje kapljice fluorhoridne kisline. Takšen je primer steklenih steklenic, ko reagirajo s HF.
Elektronska stabilnost
Zgornje značilnosti so povezane s termodinamično stabilnostjo, ki izhaja iz narave medmolekulskih interakcij, poleg drugih dejavnikov. Po drugi strani je kemična inercija videti tudi v elektronskih značilnostih istih atomov.
Bolj stabilna je elektronska konfiguracija atoma, manjša je njegova nagnjenost k zmagi ali izgubi elektronov. Zato bo pokazal večjo kemično inercijo. To je primer plemenitih plinov, ki jih bomo videli v naslednjem razdelku.
Bioinaktivnost
V medicini je snov ali material inerten, če nima bioaktivnosti. To pomeni, da se lahko nahaja znotraj organizma, ne da bi se med presnovo asimilirali. Ta lastnost je zelo zaželena v kostnih protezah ali pri rekonstrukciji tkiv.
Odpornost na sevanje
Končno bi morale biti inertne snovi ali materiali odporni na sevanje, biti ultravijolični ali jedrski.
Primeri kemične inercije
Kozarec
 Steklo je razmeroma inerten material
Steklo je razmeroma inerten material Med primeri materialov, ki imajo kemično inercijo, imamo kozarec. Če ne bi bili inertni, ne bi služili za izdelavo zabojnikov ali zabojnikov, saj bi reagirali z njihovo vsebino. Glede na njihovo sestavo, kot so borosilikati, lahko postanejo zelo odporni na korozijo in temperaturo.
Vendar, kot je omenjeno na začetku, steklo ni imuno na vse snovi: reagira s HF, celo razredčenim, vroče alkalije, kot sta NaOH in H3Po4 Zelo koncentrirano in vroče.
Vam lahko služi: pirolizaPlastika
 Če Teflonova ponev ne bi bila inertna, bi pokvarila vso hrano, ki smo jo skuhali v njej. Vir: Mdevicente, CC0, prek Wikimedia Commons
Če Teflonova ponev ne bi bila inertna, bi pokvarila vso hrano, ki smo jo skuhali v njej. Vir: Mdevicente, CC0, prek Wikimedia Commons Plastika izpolnjuje tudi funkcije, podobne funkciji stekla, vendar jih je veliko več vsestranskih (ne zlomi se tako enostavno). Nekatere plastike, kot so teflon (politetrafluoroetilen), kinar (poliviniliden fluorid) in telena (polidiciklopentadien), so izjemno odporni na napad kislin in korozije.
Keramika
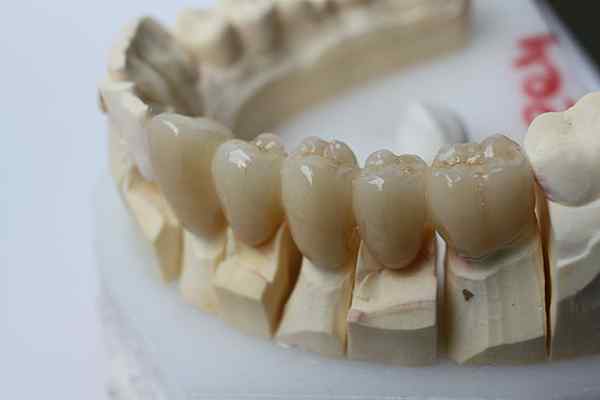 Kemična vztrajnost cirkonije omogoča uporabo za zobne proteze. Vir: bin im Garten prek Wikipedije.
Kemična vztrajnost cirkonije omogoča uporabo za zobne proteze. Vir: bin im Garten prek Wikipedije. Inertna keramika gre še korak dlje od plastike. Namenjeni so aplikacijam, kjer prevladujejo visoke temperature, precej običajne v avtomobilski in vesoljski industriji; ali v biokemičnih sistemih, kot v farmacevtski industriji in pri izvajanju kostnih protez.
Med nekatere od teh keramike z veliko kemično inercijo imamo: alumina (do2Tudi3, Prisotni v Corindonu in Sapphireu), silikati (specializirano steklo), silicijevega karbida (sic, trdi in trdovratni) in cirkoniji (Zio2).
Inertni plini
Če pustimo inertne materiale na stran, imamo zdaj inertne snovi. Inertni plini niso zelo reaktivni, zato njihova prisotnost v zraku ne pomeni tveganja za reakcijo v normalnih pogojih.
Med temi plini imamo co2, Co in n2. Dušik je najbolj inerten od vseh teh plinov; In vendar je sposoben vroče reagirati z nekaterimi kovinami, da tvori nituros, m3Nn, biti n Valencia ali kovinsko oksidacijsko stanje.
Co2 Je relativno inerten; Razen kadar se srečuje z alkalnimi rešitvami, kjer se pretvori v karbonate ali ob prisotnosti premogovnih anhidralnih encimov.
CO ostane inerten pri sobni temperaturi; Toda pri visokih temperaturah reagira s premog, vodno paro, kovinskimi oksidi, olefini, med drugimi spojinami.
Vam lahko služi: kemično ravnovesje: razlaga, dejavniki, vrste, primeriTakšne reakcije se lahko nadaljujejo v prisotnosti kovinskih katalizatorjev. Prav tako lahko CO, tudi ne da bi zlomil svoje kovalentne vezi, lahko usklajeval nevtralne kovinske atome.
Plemenite kovine
Plemenite kovine so najbolj odporne na korozijo in napad kislin in alkalij. Vsak bo pri visokih temperaturah ali v obliki prahu reagiral s kisikom ali fluoridom. Zato je kemična vztrajnost teh elementov povsem relativna.
Med plemenitimi kovinami imamo: Gold (Au), Ruthenio (Ru), Platinum (PT), Paladio (PD), Osmio (OS) in Iridido (IR). Od vseh je zlato najplemenitejše, saj je celo v kovinskem stanju v Zemljini skorji.
Plemenite plini
In končno, na najvišjem sedežu kemične inercije imamo plemenite pline: helij (he), neonski (ne), argon (AR), Crypton (KR), Xenon (Xe) in Radon (RN). Vsi so izjemno inertni. Vendar so bile sintetizirane številne spojine ksenona, vključno s soli, znanimi kot perxenatos, z Xeo Anionom64-.
 Neonske luči ustrezajo najbolj inertnim kemičnim elementom narave
Neonske luči ustrezajo najbolj inertnim kemičnim elementom narave Njegova kemična inercija je zato, ker njihovi atomi vsebujejo njihovo energijo in orbitalne plasti, popolnoma polne elektronov. Iz argona je mogoče, da bodo pod ultrapresiji dostopali do elektronov z uporabo praznih orbitalnih ali več energijskih plasti (na primer 3D in 4S); stvar, ki je nemogoče za helij ali neon.
Plemenitih plinov natančno helij in neonski sta najbolj inertna. Helij lahko tvori spojine z natrijem do zelo visokih pritisk (HENA).
Medtem sploh ni nobene spojine, saj je zaradi večje učinkovite jedrske obremenitve še bolj inerten kot sam helij, kar močno odbija vsakega atoma, ki se trudi približati neonskim atomom.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Kemija InorgánICA. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2020). Kemično inerten. Pridobljeno iz: v.Wikipedija.org
- Doktor. Doug Stewart. (2020). Definicija inertnega. Okrevano od: Chemicool.com
- Elsevier b.V. (2020). Kemična inertnost. Znanstveno. Pridobljeno iz: SCINCEDIRECT.com
- Clara Moskowitz. (20. marec 2018). Plemenito plinsko presenečenje: helij lahko tvori čudne spojine. Okreval od: znanstveni ameriški.com
- Coorstek. (2020). Kemične lastnosti tehnične keramike. Okreval od: coorstek.com
- Osborne Industries. (2020). 3 najbolj kislinsko odporne plastike. Okrevano od: Osborneindustries.com

