Lastnosti klora oksida (iii), struktura, uporabe
- 1860
- 69
- Dexter Koch
On Klorin oksid (III) To je anorganska spojina, katere kemijska formula je Cl2Tudi3. Ustreza anhidridu kloro kisline, hclo2. Je temno rjava trdna, zelo eksplozivna tudi pri temperaturah pod 0 ° C in slabo označena. Zato je predmet interesa za računalniške študije.
Kemično gre za kovalentni oksid, zato obstajajo CL-O vezi in diskretna molekula Cl2Tudi3 (spodnja slika). Ta molekula lahko dobro tvori dehidriranje hclo2, ali z izpodbijanjem nizkih temperatur. Podrobnost je, da razpade, ki proizvaja Cl2, Tudi2, ali druge termodinamično bolj stabilne kloroške okside.
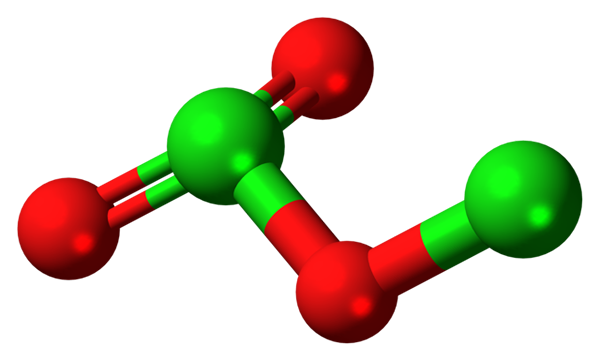
 Molekula dikloro trioksida. Vir: Jynto [CC0].
Molekula dikloro trioksida. Vir: Jynto [CC0]. Ker so vezi CL-O malo polarne, e-pošta CL2Tudi3 Ima majhen dipolski trenutek; Zato se ne raztopi v vodi ali v interakciji z drugimi polarnimi topili. Njegova nestabilnost je takšna, da ni znana komercialna ali potencialna uporaba (ali kot eksploziva bi bila uporabljena).
Glavni razlog za njegovo nestabilnost je lahko posledica elektronskih značilnosti domnevnega CL3+ (ob predpostavki čisto ionskega značaja). Pravzaprav sta njegova oksidacija +1 in +5 najbolj stabilna, kadar klor tvori spojine s kisikom.
[TOC]
Lastnosti
Ker je njegova karakterizacija slaba in ni dokumentirana, o njegovih lastnostih ni veliko reči, razen naslednjih točk:
-Ima molekulsko maso 118.903.
-Je trdno temno rjava; Čeprav lahko sublimizirate plinasti klor, rekoč rumenkasto zelene hlape.
-Manjka tako vrelo kot fuzijsko točko, saj pri 0 ° C eksplodira (in tudi pri hladnejših temperaturah).
Vam lahko služi: dihidroksiaceton fosfat (DHAP): značilnosti in aplikacije-Njegova topnost v vodi je ocenjena okoli 3,42 g/100 ml, kar dokazuje, da je kovalentna molekula nizke polarnosti.
-Reagira z vodo (malo se raztopi), da postane HClo2:
Cl2Tudi3 + H2Ali 2HClo2
Struktura klora oksida (III)
Na sliki je bila prikazana molekularna struktura CL2Tudi3 Z modelom sfer in palic. Čeprav se zdi, da se s prostim očesom ne zdi, so tihe posledice njihovih prostorskih povezav in dogovorov bolj zapletene, kot se zdijo. Ta struktura ustreza enemu od številnih možnih izomerov za to spojino.
Rdeče kroglice ustrezajo atomom kisika, zelene atome klora. Klor na levi predstavlja trigonalno geometrijo piramide z nekaj prostimi elektroni; Torej lahko domnevamo, da mora biti vaša hibridizacija SP3. Atom kisika deluje kot most med dvema klorosoma, CL-O-CL.
Izomeri
Kateri so drugi izomeri? V teoriji se izračunajo devet, od katerih so štirje najbolj stabilni (vključno s sliko). Ostali trije bi imeli strukture, kot so:
-Clclo3. Zelo podobno tistemu, ki je razloženo, vendar s povezavo CL-CL.
-Cloooocl (1). V tem izomerju je most treh kisika, ki ločuje dva atoma klora (ne pozabite na kotno geometrijo H2Ali za vizualizacijo).
-Cloooocl (2). V tem izomerju je prisoten tudi isti oksigenirani most, razen dveh atomov klora sta v vesolju zasenčeni; ena pred drugim, medtem ko so v prejšnjem izomeru oddaljeni.
Lahko vam služi: AlquinosNomenklatura
Njegovo ime, klor oksid (III), ustreza dodeljenemu v skladu z nomenklaturo zalog. Tu se domneva, da ima klor stanje oksidacije +3; Vendar to ne pomeni, da se3+ je lahko prisoten. To je molekula in ne ionsko omrežje.
Drugo ime, s katerim je znan tudi CL2Tudi3 To je dikloro trioksid, glede na sistematično nomenklaturo.
In končno. To ime je posledica dejstva, da je, kot je že razloženo, CL2Tudi3 Pojavi se, ko hclo2 Kondenzira zalivanje vode.
Prijave
Ker gre za klorov oksid, bi lahko najbolj neposredna uporaba razmišljala za CL2Tudi3 Je kot oksidacijsko sredstvo, ki lahko nevtralizira organske nečistoče in mikrobe. Vendar je poleg eksploziva zelo nestabilen, tako da se v ta namen šteje za koristno.
Zagotovo ni nobenih informacij, kako bi se CL obnašal2Tudi3 pod velikimi pritiski (če v postopku ne eksplodira). V normalnih pogojih se zdi, da ni nič drugega kot razmeroma stabilen in različen posrednik med drugimi bolj stabilnimi klorovimi oksidi.
Računalno pa je bilo podvrženo preučevanju mehanizmov s prostimi radikali, ki vključujejo več vrst klora in kisika.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2019). Diklor trioksida. Pridobljeno iz: v.Wikipedija.org
- Daj mu l. Perry. (2011). Priročnik anorganskih spojin. (Druga izdaja). CRC Press Taylor & Francis Group.
- Richard c. Ropp. (2013). Enciklopedija alkalnih zemeljskih spojin. Elsevier.
- Kim k. H., Han in.K., in branje in. S. (1999). Osnovni učinki na stabilnost izomerov CL2O3 z uporabo B3P86 in B3LYP metod funkcionalne teorije gostote. Časopis za molekularno strukturo Theochem 460 (1-3): 19-25.
- « Struktura železovega hidroksida (II), lastnosti, uporabe
- Struktura tetrodotoksina, značilnosti, uporabe, učinki »

