Hidracy
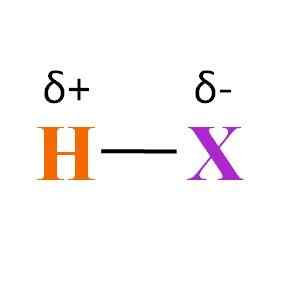
- 1844
- 512
- Miguel Gutmann DVM
Kaj so hidrace?
The Hidracy, o binarne kisline, so spojine, raztopljene v vodi, ki so sestavljeni iz vodika in nemetalnega elementa: vodikove halogenide. Njegova splošna kemična formula se lahko izrazi kot HX, kjer je H atom vodika, in x ne -metalni element.
X lahko spada v skupino 17, halogene ali elementom skupine 16, ne da bi vključeval kisik. Za razliko od oksoacidov hidracide nimajo kisika. Ker so hidraceidi kovalentne ali molekularne spojine, je treba upoštevati povezavo H-X. To je zelo pomembno in definira značilnosti vsakega hidratosti.
H-X povezava
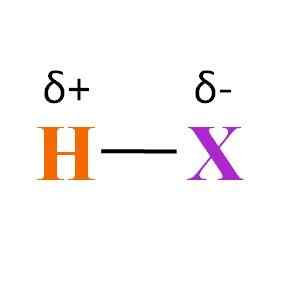 Splošna kemična formula hidratacije. Vir: Gabriel Bolívar
Splošna kemična formula hidratacije. Vir: Gabriel Bolívar Kaj lahko rečemo o povezavi H-X? Kot je razvidno iz vrhunske slike, obstaja trajni dipolski momentni produkt različnih elektronegativnosti med H in X. Ker je X običajno bolj elektronegativen kot H, privlači svoj elektronski oblak in se konča z negativno delno obremenitvijo δ-.
Namesto H, ko del svoje elektronske gostote daje X, se konča s pozitivno delno obremenitvijo δ+. Bolj negativni Δ-, najbogatejši bo v elektronih x in večje je elektronsko pomanjkanje H. Zato je hidracenca, odvisno od tega, kaj je element, bolj ali manj polarna.
Slika prikazuje tudi strukturo hidracid. H-X je linearna molekula, ki lahko z drugim komunicira z enim od njegovih koncev. Bolj polarna je HX, njegove molekule bodo vplivale na večjo silo ali afiniteto. Kot rezultat, se bodo njegove vrelišča ali fuzijske točke povečale.
Vendar pa interakcije H-X-H-X ostajajo dovolj šibke, da lahko povzročijo trdno hidraco. Zato so pod pogoji tlaka in temperature v okolici plinaste snovi; razen HF, ki izhlapi nad 20 ° C.
Ker? Ker je HF sposoben tvoriti močne vodikove mostove. Medtem ko so drugi Hydraceidi, katerih nemetalni elementi so manj elektronegativni, komaj lahko v tekoči fazi pod 0 ° C. HCl, na primer, zavremo pri -85 ° C približno.
So hidracijske kislinske snovi? Odgovor je v pozitivni delni obremenitvi Δ+ na atomu vodika. Če je Δ+ zelo velik ali zelo šibka H-X vez, bo HX močna kislina, kot je to primer pri vseh halogenskih hidracenih, ko se njihovi halogenidi raztopijo v vodi.
Značilnosti hidrace
Fizično
Prozorne rešitve
Vidno vse hidracide so prozorne rešitve, saj so HX v vodi zelo topni. Lahko imajo rumenkaste tone glede na raztopljene koncentracije HX.
Kadijo
To pomeni, da oddajajo goste, jedke in dražilne hlape (nekateri so celo slabosti). To je zato, ker so molekule HX zelo nestanovitne in sodelujejo z vodno paro, ki obdaja rešitve. Poleg tega so HX v njihovih brezvodnih oblikah plinaste spojine.
So električni vodniki
Hidracy so dobri elektroenergetski prevodniki. Čeprav so HX plinaste vrste do atmosferskih pogojev, ko se raztopijo v vodi+X-), ki omogočajo prehod električnega toka.
Vam lahko služi: termodinamični procesiNjegove vrelišča so višje od tistih njihovih brezvodnih oblik
To pomeni HX (AC), ki označuje hidracijo, vre pri temperaturah, višjih od HX (g). Na primer, vodikov klorid, HCl (G), zavre pri -85 ° C, vendar hidrahlorična kislina, njeno hidracijo, približno 48 ° C.
Ker? Ker so plinaste molekule HX obdane z vodo. Med njimi se lahko hkrati pojavita dve vrsti interakcij: HX - H mostovi2Ali - hx ali ionsko reševanje, h3Tudi+(Ac) in x-(AC). To dejstvo je neposredno povezano s kemičnimi značilnostmi hidrace.
Kemikalije
Hidracidi so zelo kisle raztopine, zato imajo kisle protone h3Tudi+ na voljo za reagiranje z drugimi snovmi.
Kje se pojavi h3Tudi+? Atoma vodika s pozitivno delno obremenitvijo Δ+, ki se disociira v vodi in na koncu kovalentno vključi v molekulo vode:
Hx (ac) + h2O (l) x-(Ac) + h3Tudi+(AC)
Upoštevajte, da enačba ustreza reakciji, ki vzpostavlja ravnotežje. Ko tvorba x-(Ac) + h3Tudi+(AC) je termodinamično zelo favoriziran, HX bo svoj vodni proton sprostil v vodo; In potem to, s h3Tudi+ Kot novi "nosilci" lahko reagirate z drugo spojino, tudi če slednja ni močna osnova.
Zgoraj pojasnjuje kislinske značilnosti hidrace. To se zgodi za vse HX, raztopljene v vodi; Toda nekateri ustvarjajo več kislinskih rešitev kot druge. Kaj je to? Razlogi so lahko zelo zapleteni. Niso vsi HX (AC) naklonjeni prejšnjemu ravnovesju na desni, torej proti X-(Ac) + h3Tudi+(AC).
Kislost
In izjemo opazimo v fluorhorični kislini, HF (AC). Fluor je zelo elektronegativen, zato skrajša razdaljo povezave H-X in jo okrepi pred svojo rupturo z vodnim delovanjem.
Prav tako ima povezava H-F veliko boljše prekrivanje zaradi atomskih radijskih sprejemnikov. Po drugi strani so povezave H-CL, H-BR ali H-I šibkejše in se ponavadi popolnoma ločijo v vodi, do točke, da se lomijo z zgoraj navedenim ravnotežjem.
To je zato, ker imajo drugi halogeni ali kalkogeni (na primer žveplo) večje atomske radijske sprejemnike in zato bolj zajetne orbitale. Posledično je povezava H-X najrevnejša orbitalna prekrivanje, saj je X večji, kar ima kislinsko silo, ko so v stiku z vodo.
Na ta način je padajoči vrstni red kislosti za halogenske hidracide naslednji: HF< HCl V svojih brezvodnih oblikah, HX (g), jih je treba omeniti kot narekovati za vodikove halogenide: dodajanje priponke -Aurohi Na koncu njihovih imen. Na primer, HI (G) je sestavljen iz halogenida (ali hidrida), ki ga tvorita vodik in jod, zato je njegovo ime: YodAurohi vodika. Ker so običajno ne -komele bolj elektronegativne kot vodik, ima oksidacijsko število +1. V NAH ima vodik oksidacijsko število -1. To je še en posredni način razlikovanja molekulskih hidrorjev od halogena ali vodikovih halogenidov iz drugih spojin. Ko je HX (g) med stikom z vodo, je predstavljen kot HX (AC) in ima nato hidracijo. Če želite imenovati hidrato, HX (AC), bo treba pripono zamenjati -Aurohi njegovih brezvodnih oblik po priponi -Voda. In je treba najprej omeniti kot kisline. Tako je za prejšnji primer HI (AC) poimenovan kot: yod kislinaVoda. Hidraceidi lahko tvorijo s preprostim raztapljanjem ustreznih vodikovih halogenidov v vodi. To je mogoče predstaviti z naslednjo kemijsko enačbo: Hx (g) => hx (ac) HX (g) je v vodi zelo topen, zato ni ravnovesja topnosti, za razliko od njegove ionske disociacije, da sprosti kislinske protone. Vendar je prednostna sintetična metoda, ker uporablja kot surovine ali minerale, ki jih raztaplja pri nizkih temperaturah z močnimi kislinami. Če se namizna sol, NaCl, raztopi s koncentrirano žveplovo kislino, pride do naslednje reakcije: NaCl (s) +h2SW4(AC) => HCl (AC) +NAHSO4(AC) Žveplova kislina podari enega od njegovih kislinskih protonov v anion klorid Cl-, Tako ga spremenite v klorovodikovo kislino. Iz te mešanice se lahko izogne vodikovi kloridu, HCl (G), ker je zelo hlapna, še posebej, če je njegova koncentracija v vodi zelo visoka. Druga proizvedena sol je natrijev kislina sulfat, Nahso4. Drug način za proizvodnjo je nadomeščanje žveplove kisline s koncentrirano fosforno kislino: NaCl (s) + h3Po4(AC) => HCl (AC) + NAH2Po4(AC) H3Po4 reagira na enak način kot h2SW4, Proizvodnja fosfata klorovodikove in natrije. NaCl je vir cl aniona-, tako da so potrebne sintetiziranje drugih hidracest, soli ali mineralov, ki vsebujejo F-, Br-, Yo-, S2-, itd. Toda uporaba h2SW4 ali h3Po4 Odvisno bo od njegove oksidativne sile. H2SW4 To je zelo močno oksidacijsko sredstvo, do te mere, da oksidira celo BR- in jaz- do svojih molekularnih oblik Br2 in jaz2; Prva je rdečkasta tekočina, druga pa vijolična trdna. Zato h3Po4 predstavlja prednostno alternativo pri takšni sintezi. Hidracidi v bistvu se uporabljajo za raztapljanje različnih vrst snovi. To je zato, ker so močne kisline in zmerno lahko očistijo katero koli površino. Njihovi kislinski protoni se dodajo spojinam nečistoč ali umazanije, zaradi česar so topni v vodnem okolju in jih nato vleče voda. Glede na kemično naravo omenjene površine je mogoče uporabiti hidrato ali drugo. Na primer, fluorhorhorhorske kisline ni mogoče uporabiti za čiščenje stekla, saj bi jih v dejanju raztopilo. Klorovodikova kislina se uporablja za odstranjevanje lis na ploščicah. Prav tako so sposobni raztapljati kamnine ali trdne vzorce, nato pa se za analitične ali proizvodne namene uporabljajo za majhne ali velike lestvice. V ionski izmenjalni kromatografiji se za čiščenje preostalega ionskega stolpca uporablja razredčena klorovodikova kislina. Nekatere reakcije zahtevajo zelo kisle rešitve, da jih pospešijo in zmanjšajo čas, ki ga je. Tu vstopijo hidracidi. Primer tega je uporaba iarhidrične kisline pri sintezi ledene ocetne kisline. Naftna industrija potrebuje tudi hidracero v procesih rafinerije. Hidracidi ne zagotavljajo samo kislinskih protonov, ampak tudi njihovih anionov. Ti anioni lahko reagirajo z organsko ali anorgansko spojino, da tvorijo specifično halogenid. Na ta način fluoridi, kloridi, jodid. Ti halurosi imajo lahko zelo raznolike aplikacije. Na primer, lahko jih uporabimo za sintezo polimerov, kot je teflon; ali posredniki, iz katerih bodo halogenski atomi vključeni v molekularne strukture nekaterih zdravil. Recimo, da molekula ch3Pogl2Oh, etanol, reagira s HCl, da tvori etil klorid: Pogl3Pogl2Oh + hcl => ch3Pogl2Cl + H2Tudi Vsaka od teh reakcij skriva mehanizem in številne vidike, ki jih upoštevamo v organski sintezi. Za hidracide ni na voljo veliko primerov, saj je število možnih spojin naravno omejeno. Zaradi tega so spodaj navedeni nekateri dodatni hidracidi z njihovo nomenklaturo (kratica (AC)) se ne upošteva: Binarna hidraceida, katere molekule H-F tvorijo močne vodikove mostove, do te mere, da je v vodi šibka kislina. Za razliko od obravnavanih hidracidov je poliatomsko, to je, da ima več kot dva atoma, vendar je še naprej binarni, saj sta dva elementa: žveplo in vodik. Njegove kotne molekule H-S-H ne tvorijo občutljivih vodikovih mostov in jih je mogoče zaznati z njihovo značilno gnilobo gnilega jajca. Ena najbolj znanih kislin v popularni kulturi. To je celo del sestave želodčnega soka, prisoten v želodcu, in skupaj s prebavnimi encimi razgradijo hrano. Kot iarhidrična kislina je v plinski fazi sestavljena iz linearnih molekul H-BR, ki se disociirajo na H ionih+ (H3Tudi+) in br- Ko vstopijo v vodo. Čeprav ima Telurio določen kovinski značaj, njegova hidracenca oddaja neprijetne in izjemno strupene hlape, kot je seleenhidrična kislina. Kot tudi drugo hidracijo sledi2-, Torej je njegova Valencia -2.Nomenklatura hidracidov
Brezvodna oblika
V vodni raztopini
Kako so hidrace?
Neposredno raztapljanje vodikovih halogenidov
Raztapljanje ne -kometalnih soli s kislinami
Uporaba hidrace
Čistila in topila
Kislinski katalizatorji
Reagenti za sintezo organskih in anorganskih spojin
Primeri hidracestov
HF, fluorhorična kislina
H2S, sulfhidrična kislina
HCl, klorovodikova kislina
HBR, bromhidrična kislina
H2Čaj, telurhidrična kislina
Reference

