Londonske sile
- 4556
- 1121
- Ignacio Barrows
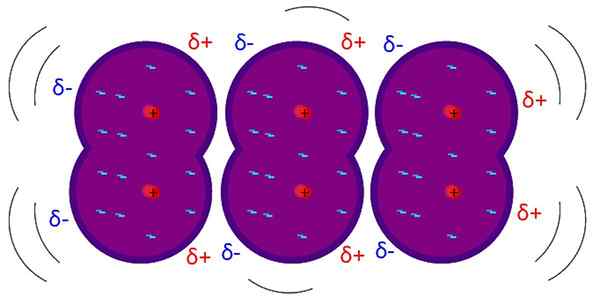
 Londonske sile so medmolekularne šibke interakcije. Vir: Riccardo Rovinetti, Wikimedia Commons
Londonske sile so medmolekularne šibke interakcije. Vir: Riccardo Rovinetti, Wikimedia Commons Kaj so sile Londona?
The Londonske sile, Londonske disperzijske sile ali interakcije z induciranimi dipoli so najšibkejša vrsta intermolekulskih interakcij. Njegovo ime je posledica prispevkov teoretičnega fizika Fritz London (1900-1954) in njegovih študij na področju kvantne fizike.
Londonske sile pojasnjujejo, kako molekule medsebojno delujejo, katerih strukture in atomi tvorijo trajni dipol; to pomeni, da v bistvu velja za apolarne molekule ali atome, izolirane iz plemenitih plinov.
Za razliko od drugih sil Van der Waals to zahteva izjemno kratke razdalje.
Značilnosti londonskih sil
 Porazdelitev homogenih stroškov. Vir: Gabriel Bolívar
Porazdelitev homogenih stroškov. Vir: Gabriel Bolívar Katere značilnosti bi morala imeti molekula, da lahko medsebojno deluje prek londonskih sil? Odgovor je, da bi to lahko storil kdorkoli, ko pa je trajni dipolski trenutek, prevladujejo interakcije dipola-dipolo in ne disperzija, ki zelo malo prispevajo k fizični naravi snovi.
V strukturah, kjer ni zelo elektronegativnih atomov ali katerih je elektrostatična porazdelitev obremenitve homogena, ni konca ali regije, ki bi ga lahko šteli za bogato (Δ-) ali slabo (Δ+) v elektronih.
V teh primerih morajo druge vrste sil posredovati ali kako drugače lahko te spojine obstajajo le v plinski fazi, ne glede na to, da na njih delujejo celo tlačni ali temperaturni pogoji.
Homogena porazdelitev obremenitve
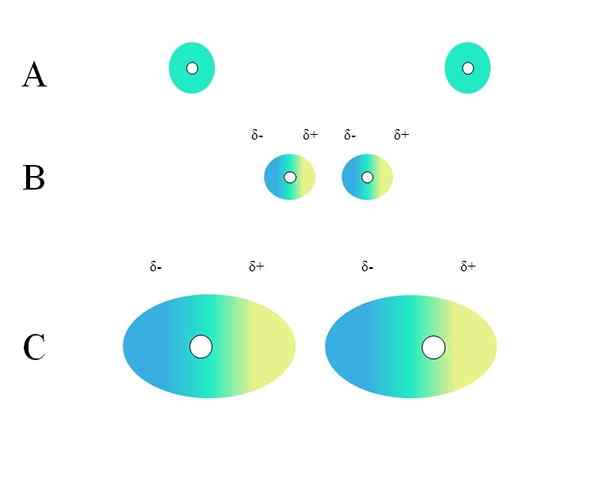
Dva osamljena atoma, kot sta neonski ali argon, imata homogeno porazdelitev obremenitve. To je razvidno iz nadrejene slike. Beli krogi v središču predstavljajo jedra za atome ali molekularno okostje za molekule. To porazdelitev obremenitve lahko štejemo za oblak zelenih elektronov.
Zakaj plemeniti plini izpolnjujejo to homogenost? Ker imajo svojo elektronsko plast popolnoma polno, zato morajo njihovi elektroni teoretično začutiti enako privlačnost jedra v vseh orbitalih.
Po drugi strani je za druge pline, kot je atomski kisik (O)2 Za kompenzacijo te pomanjkljivosti.
Zeleni krogi A so lahko tudi molekule, majhne ali velike. Njegovi orbiti elektroni oblačijo okoli vseh atomov, ki jih sestavljajo, zlasti o najbolj elektronegativnem. Okoli teh atomov se bo oblak osredotočil in bo bolj negativen, drugi atomi pa bodo imeli elektronsko pomanjkanje.
Vam lahko služi: ne -polarna kovalentna vezVendar ta oblak ni statičen, ampak dinamičen, zato se v nekem trenutku oblikujejo kratki regiji Δ- in Δ+in pojavil se bo pojav Polarizacija.
Polarizabilnost
V zelenem oblaku kaže na homogeno negativno porazdelitev obremenitve. Vendar pa lahko pozitivna privlačnost, ki jo izvaja jedro. To povzroči deformacijo v oblaku in tako ustvari δ-regije, modre in Δ+, rumeno.
Ta nenadni dipolni trenutek v atomu ali molekuli lahko izkrivlja sosednji elektronski oblak; Z drugimi besedami, povzroči nenaden dipol nad sosedom (B, nadrejena slika).
To je zato, ker δ-območje moti sosednji oblak, njegovi elektroni čutijo elektrostatično odbojnost in so usmerjeni v nasprotni polu, ki se pojavljajo δ+.
Upoštevajte, kako so pozitivni drogovi usklajeni z negativnimi, tako kot molekule s trajnimi dipolnimi trenutki. Bolj kot voluminozen je elektronski oblak, večje je jedro, ki ga bo v vesolju ohranjal homogeno; In poleg tega bo to deformacija, kot je razvidno iz C.
Zato majhni atomi in molekule verjetno ne bodo polarizirali nobenih delcev svoje okolice. Primer za to situacijo ponazarja majhna molekula vodika, h2.
Za kondenziranje ali celo več kristalizacije potrebuje pretirane pritiske, da svoje molekule prisili v fizično interakcijo.
Je obratno sorazmerna z razdaljo
Čeprav se tvorijo takojšnji dipoli, ki sprožijo druge okoli njih, niso dovolj, da bi atome ali molekule ohranili skupaj.
V B je razdalja d ki ločuje oba oblaka in njuna dva jedra. Tako da lahko oba dipola ostaneta za nekaj časa, to razdaljo d Mora biti zelo majhno.
Ta pogoj mora biti izpolnjen, bistvena značilnost londonskih sil (ne pozabite zapiranje Velcro), tako da je na voljo zloglasni vpliv na fizične lastnosti zadeve.
Enkrat d Bodite majhni, jedro levice v B bo začelo privabiti modro območje δ- sosednjega atoma ali molekule. To bo še dodatno deformiralo oblak, kot je razvidno iz C (jedro ni več v središču, ampak na desni).
Vam lahko služi: alkeniPotem je tu točka, ko se oba oblaka dotikata in "odbijeta", vendar do dovolj počasnosti, da jih imata skupaj s časom.
Zato so londonske sile obratno sorazmerne z razdaljo d. Pravzaprav je faktor enak d7, Tako bo minimalna variacija razdalje med atomi ali molekulami oslabila ali okrepila disperzijo Londona.
Je neposredno sorazmerna z molekularno maso
Kako povečati velikost oblakov, tako da jih je lažje polarizirati? Dodajanje elektronov in za to mora imeti jedro več protonov in nevtronov, s čimer se poveča atomska masa; ali dodajanje atomov v okostje molekule, kar bi posledično povečalo njegovo molekularno maso.
Na ta način bi bilo jedro ali molekulsko okostje manj verjetno, da bodo ves čas obdržali elektronski oblak. Zato so večji zeleni krogi, obravnavani v A, B in C, bolj polarizabilni in večji bodo tudi njihovi interakciji londonskih sil.
Ta učinek je jasno opažen med B in C, še bolj pa bi lahko bilo, če bi bili krogi večjega premera. Ta sklep je ključnega pomena za razlago fizikalnih lastnosti številnih spojin, odvisno od njihovih molekulskih mas.
Primeri londonskih sil
 Naravni primer londonskih sil: noge Gecos
Naravni primer londonskih sil: noge Gecos V naravi
V vsakdanjem življenju je nešteto primerov londonskih disperzijskih sil brez potrebe po odhodu, najprej mikroskopski svet.
Eden najpogostejših in presenetljivih primerov najdemo v nogah plazilcev, znanih kot Gecos (Superior Image) in pri mnogih žuželkah (tudi v Spidermanu).
V svojih nogah imajo nekaj blazinic, od katerih na tisoče majhnih nitk izstopa. Na sliki lahko vidite geco, ki pozira na pobočju skale. Da bi to dosegli, uporablja medmolekularne sile med skalo in nitkami njihovih nog.
Vsaka od teh filamentov šibko deluje s površino, skozi katero je majhen plazilec. Gecos se lahko tudi povzpnejo gladke in popolne površine, kot so kristali.
Lahko vam služi: kalijev nitrit (KNO2): struktura, lastnosti in uporabeZapre
Alkani so nasičeni ogljikovodiki, ki delujejo tudi s londonskimi silami. Njegove molekularne strukture so preprosto sestavljene iz ogljika in vodikov, združenih s preprostimi vezmi. Ker je razlika v elektronegativnosti med C in H zelo majhna, so to apolarne spojine.
Tako, metan, cho4, Najmanjši ogljikovodik od vseh, zavre pri -161.7. c. Ker se C in H dodajata skeletu, dobimo druge alkane z višjimi molekularnimi masami.
Na ta način se pojavi etan (-88.6. c), butan (-0.5. c) in oktana (125.7. c). Upoštevajte, kako se njihove vrelišča povečujejo, ko Alkani postanejo težji.
To je zato, ker so njihovi elektronski oblaki bolj polarizabilni in njihove strukture imajo večje površinsko območje, ki povečujejo stik med molekulami.
Oktan, čeprav je apolarna spojina, ima vrelišče, večjo od vode.
Halogeni in plini
Londonske sile so prisotne tudi v številnih plinastih snovi. Na primer N molekule2, H2, Co2, F2, Cl2 In vsi plemeniti plini delujejo prek teh sil, saj imajo homogeno elektrostatično porazdelitev, ki lahko utrpi posnetek in povzroči polarizacijo.
Plemenite plini so on (helij), neonski (neonski), ar (argon), KR (Kripton), Xe (Xenon) in RN (radon). Od leve proti desni se njihove vrelišča povečujejo s povečanjem atomskih mas: -269, -246, -186, -152, -108 in -62 ° C.
Halogeni sodelujejo tudi prek teh sil. Fluor je plin pri sobni temperaturi, tako kot klor. Brom, z večjo atomsko maso, je v normalnih pogojih, kot je rdečkasta tekočina, in jod, do konca, tvori vijolično trdno snov, ki hitro sublimira, ker je težja od drugih halogenov.
Reference
- Whitten, Davis, Peck & Stanley. Kemija. (8. izd.). Cengage Learning, P 452-455.
- Angeles Méndez. (22. maja 2012). Disperzijske sile (iz Londona). Okrevano od: Kemija.Laguia2000.com
- Londonske disperzijske sile. Okrevano od: kem.Purdue.Edu
- Čelada, Anne Marie, ph.D. (22. junij 2018). 3 vrste medmolekularnih sil. Okreval od: Thoughtco.com
- Ryan Ilagan & Gary L Bertrand. Londonske disperzijske interakcije. Vzet od: kem.Librettexts.org
- ChemPages norials. Londonske sile. Okrevano od: kem.WISC.Edu
- Kamereon. (22. maja 2013). Salamanqueas: Geco in sile Van der Waalsa. Okrevano od: almabiologica.com

