Struktura, lastnosti in uporabe heptano (C7H16)
- 1611
- 270
- Barry Ernser
On Heptano Gre za organsko spojino, katere kemična formula je c7H16 in obsega devet strukturnih izomerov, od katerih je najbolj znana linearna. Gre.
Za razliko od drugih parafinskih topil ima Heptano nižjo nestanovitnost, zaradi česar je njegova razmeroma varnejša; Kadarkoli ni vira toplote, ki obdaja vaše hlape in se obdeluje v zvoncu ekstraktorja. Če pustite svojo vnetljivost na stran, je dovolj inertna spojina, da služi kot sredstvo za organske reakcije.
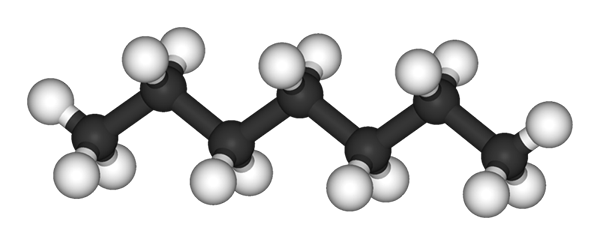
 N-heptano molekula, ki jo predstavlja model sfer in palic. Vir: Ben Mills in Jynto [Public Domain]
N-heptano molekula, ki jo predstavlja model sfer in palic. Vir: Ben Mills in Jynto [Public Domain] Na zgornji sliki imate strukturo n-Heptano, linearni izomer vseh heptanov. Ker je najpogostejši izomer in večje komercialne vrednosti, pa tudi najlažje za sintetiziranje, na koncu je na koncu, da se izraz "heptano" nanaša izključno na n-heptano; razen če ni drugače navedeno.
Vendar je v steklenicah te tekoče spojine določeno, da vsebuje n-Heptano. Odkriti se morajo znotraj zvona ekstraktorja in natančno opraviti meritve.
Je odlično topilo za maščobe in olja, zato se pogosto uporablja med rastlinskimi esencami ali drugimi naravnimi izdelki.
[TOC]
Struktura
N-HEPTAN IN NJEGOVIH INTERMOLEKULARNIH
Kot je razvidno iz prve slike, molekula n-Heptano je linearni in zaradi kemične hibridizacije svojih ogljikovih atomov veriga sprejme obliko cikcagueda. Ta molekula je dinamična, saj se lahko njene C-C vezi vrtijo, zaradi česar je veriga rahlo pregibna pod različnimi koti. To prispeva k njegovim medmolekularnim interakcijam.
Lahko vam služi: pi povezavaOn n-Heptano je apolarna, hidrofobna molekula, zato njegove interakcije temeljijo na londonskih disperzivnih silah; To so tisti, ki so odvisni od molekulske mase spojine in njegovega kontaktnega območja. Dve molekuli n-heptan.
Te interakcije so dovolj učinkovite za vzdrževanje molekul n-kohezivno heptano v tekočini, ki zavre pri 98 ° C.
Izomeri
 Devet izomerov heptana. Vir: Steffen 962 [javna domena]
Devet izomerov heptana. Vir: Steffen 962 [javna domena] Sprva je bilo rečeno, da formula c7H16 predstavljalo skupno devet strukturnih izomerov, ki so bili n-Heptane najpomembnejši (1). Ostalih osem izomerov je prikazanih na zgornji sliki. Z golim očesom upoštevajte, da so nekateri bolj razvejani kot drugi. Od leve proti desni, začenši od zgoraj, imamo:
(2): 2-metilheksan
(3): 3-metilheksan, ki ga sestavljajo par enantiomerov (A in B)
(4): 2,2-dimetilpentano, znan tudi kot neoheptano
(5): 2,3-dimetilpentano, spet s parom enantiomerov
(6): 2,4-dimetilpentano
(7): 3,3-dimetilpentano
(8): 3-etilpentant
(9): 2,2,3-trimetilbutan.
Vsak od teh izomerov ima neodvisne lastnosti in aplikacije n-Heptano, rezerviran več kot karkoli za območja organske sinteze.
Lastnosti heptana
Fizični videz
Brezbarvna tekočina z vonjem, podobnim bencinu.
Molarna masa
100,205 g/mol
Tališče
-90.549 ° C, ki postane molekularni kristal.
Vrelišče
98,38 ° C.
Parni tlak
52,60 atm pri 20 ° C. Upoštevajte, kako visok je vaš parni tlak, čeprav je manj nestanoviten kot druga parafinska topila, kot sta heksano in pentan.
Gostota
0,6795 g/cm3. Po drugi strani so hlapi Heptano 3,45 -krat goste od zraka, kar pomeni, da bodo njihovi hlapi zdržali v prostorih, kjer malo razlitja njihove tekočine.
Vam lahko služi: mravljinska kislina (hcooh)Topnost vode
Heptane za hidrofobno spojino se lahko komaj raztopi v vodi, da povzroči raztopino s koncentracijo 0,0003% pri temperaturi 20 ° C.
Topnost v drugih topilih
Hepthana je mešan z ogljikovim tetrakloridom, etanolom, acetonom, naftnim etrom in kloroformom.
Lomni količnik (nD)
1.3855.
Goo
0,389 MPA · S
Toplotna zmogljivost
224,64 j/k · mol
točka vžiga
-4 ° C
Temperatura samostojnosti
223 ° C
Površinska napetost
19,66 mn/m a 25 ° C
Toplota zgorevanja
4817 kJ/mol.
Reaktivnost
Hepthanski hlapi Ko so blizu vira toplote (plamen), reagirajo eksotermično in odločno s kisikom zraka:
C7H16 + 11o2 => 7co2 + 8h2Tudi
Vendar je zunaj reakcije zgorevanja heptane dokaj stabilna tekočina. Njegova pomanjkanje reaktivnosti je posledica dejstva, da je njihove C-H povezave težko prekiniti, zato ni dovzetna za zamenjave. Prav tako ni zelo občutljiv na močna oksidacijska sredstva, pod pogojem, da v bližini ni požara.
Največja nevarnost Heptana je predstavljena z visoko nestanovitnostjo in vnetljivostjo, zato obstaja požarno tveganje, če se razlije na vročih mestih.
Prijave
Topilo in polovica reakcije
 Hepthane je odlično topilo za raztapljanje olj in maščob. Vir: pxhere.
Hepthane je odlično topilo za raztapljanje olj in maščob. Vir: pxhere. Hidrofobni značaj heptana je odlično topilo za raztapljanje olj in maščob. V tem vidiku je bil uporabljen kot razmaščevalec. Vendar je njegova največja uporaba v uporabi kot topilo za ekstraktor, saj raztopi lipidne komponente, pa tudi druge organske spojine vzorca.
Na primer, če želite izvleči vse sestavne dele mlete kave, bi jo namesto vode macerirali v heptanu. Ta metoda in njene različice so bile izvedene z vsemi vrstami semen, zahvaljujoč se rastlinskim esencam in drugimi naravnimi proizvodi.
Lahko vam služi: enotna celica: lastnosti, rdeče konstante in vrsteHeptan, ki je naravno brezbarven, bo barvan iz barve ekstrahiranega olja. Nato se to zasuka, da končno čim bolj čiste.
Po drugi strani vam majhna reaktivnost heptana omogoča tudi, da ste možnost, če upoštevate reakcijsko sredstvo za izvedbo sinteze. Ker je dobro topilo organskih spojin, zagotavlja, da reagenti ostanejo v raztopini in medsebojno komunicirajo, ko reagirajo.
Oborilni agent
V naftni kemiji je običajna praksa, da oborimo asfaltene surovega vzorca z dodajanjem heptana. Ta metoda omogoča preučevanje stabilnosti različnih surovin in določanje, kako dovzetna je njegova vsebnost asfaltena.
Oktan
Heptan je bil uporabljen kot gorivo zaradi velike količine toplote, ki jo ponuja, ko gori. Vendar pa bi bilo v zvezi z avtomobilskimi motorji škodljivo za njegovo delovanje, če bi ga uporabili čisto. Ker gori zelo eksplozivno, služi za določitev 0 na oktanski lestvici bencina.
Bencin vsebuje visok odstotek heptano in drugih ogljikovodikov do izravnave oktana na znane vrednosti (91, 95, 87, 89, etc.).
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. (10. izdaja.). Wiley Plus.
- Wikipedija. (2020). Heptane. Pridobljeno iz: v.Wikipedija.org
- Nacionalni center za informacije o biotehnologiji. (2020). Baza podatkov Heptane Pubchem. Cid = 8900. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Elsevier b.V. (2020). Heptani. Znanstveno. Pridobljeno iz: SCINCEDIRECT.com
- Bell Chem Corp. (7. septembra 2018). Industrijska uporaba heptana. Okreval od: Bellchem.com
- Andrea Kropp. (2020). Heptane: struktura, uporabe in formula. Študij. Okrevano od: študij.com
- « Kondenzirana formula, kaj je in primeri (metan, etan, glukoza ...)
- Mehanske energijske formule, koncept, vrste, primeri, vaje »

