Kondenzirana formula, kaj je in primeri (metan, etan, glukoza ...)
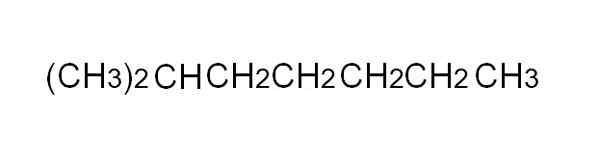
- 2040
- 7
- Roman Schamberger
The kondenzirana formula Gre za čisto besedilno predstavitev molekule, v kateri so povezave izpuščene. Njegov namen je vedeti, kaj je urejanje atomov. Na splošno linearne ali razvejane molekule imajo kondenzirane formule, razen cikličnih ali tistih, ki so zelo razvejane.
Pri organski kemiji običajno zmede, kaj je razlika med to formulo in molekularno. Pravzaprav jih je običajno najti kot sinonime. Medtem se v anorganski kemiji molekularne formule uporabljajo več, saj v večini primerov kovalentne spojine pravilno opisujejo; Kot voda, h2Tudi.
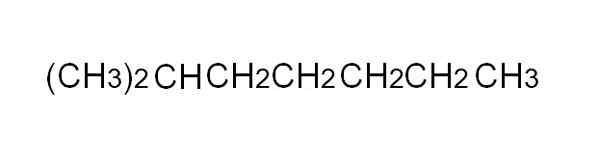 Kondenzirana formula 2-metilheptana. Vir: Gabriel Bolívar.
Kondenzirana formula 2-metilheptana. Vir: Gabriel Bolívar. [TOC]
Kakšna je kondenzirana formula?
Da bi ga bolj priročno opredelili, je kondenzirana formula poenostavljena predstavitev pol -razvitega. Ni treba pisati preprostih povezav, niti v besedilu ne smejo zajeti več kot ene vrstice. Na primer, 2-metilheptano, razvejani alkan, je lahko predstavljen v isti črti kot na zgornji sliki.
Kondenzirane formule so koristne za predstavljanje nekaterih molekul, ne da bi jih morali risati. To je odlično, kadar so zapisane kemijske enačbe, kjer ciklične ali zelo razvejane molekule ne sodelujejo. Videti bo, da se te formule zatekajo k oklepajem, da bi še dodatno poenostavili zastopanje molekule.
Primeri
Metan
Metan je edina kemična spojina, ki ima eno samo formulo: Ch4. To ustreza empiričnim, molekularnim, kondenziranim in pol razvitim hkrati. Zato večkrat, da bi prihranili zmedo med vsemi temi koncepti, ljudje raje navajajo preprosto in natančno na "kemijsko formulo" spojine.
Etano
Estano ima molekularno formulo c2H6. Namesto kondenzirane formule je CHO3Pogl3. Upoštevajte, da sta povezava C-C in C-H izpuščena. Ideja je, da lahko napisati formulo, kot da gre za "besedo", ne da bi morali risati črte ali risati strukture.
Vam lahko služi: piknometerPo definiciji je molekularna formula c2H6 in ne pogl3Pogl3; Vendar sta za preproste molekule obe formuli običajni za izmenjavo, čeprav je še vedno napačna. To je neskladna točka med več viri, kjer v zvezi s tem očitno obstajajo posebna pravila.
Glukoza in fruktoza
Tu je primer, ko se napako takoj opazi, ko želite izmenjati molekularno formulo za kondenzat.
Sladki navor glukoze in fruktoze imajo enako molekularno formulo: c6H12Tudi6, In zato to ne služi za njihovo razlikovanje. V nasprotju s tem strukturni in polrazviti formule vzpostavljajo različne molekule na vidiku.
Vendar imata glukoza ali fruktoza kondenzirano formulo. To je zato, ker ne glede na njihovo reprezentacijo ali projekcijo njihovih struktur ni mogoče zapisati v isti vrstici; Ali vsaj na način, ki je v bralčevih očeh prijeten in preprost.
Butan
Butano ima molekularno formulo c4H10. Ima dva izomera: linearna, n-Butano in razvejano, 2-metilpropane. Oba sta lahko predstavljena z njihovimi kondenziranimi formulami. On n-Butano je pogl3Pogl2Pogl2Pogl3 ali pogl3(Pogl2)2Pogl3, In 2-metilpropan je CHO3Ch (pogl3)2 ali (pogl3)3Pogl.
V 2-metilpropanu imamo skupino, obkrožen s tremi Cho3. Njeni dve formuli sta veljavni, za poudarjanje posledic pa se uporabljajo oklepaji, naročnina pa je pokazatelj, koliko skupin sestavlja to vejo.
Etanol
Etanol ima zgoščeno formulo ch3Pogl2Oh. Upoštevajte, koliko spominja na svojo polrazvižno formulo: ch3-Pogl2-Oh. Na enak način je to storjeno s propanolom, cho3Pogl2Pogl2Oh, n-Butanol, pogl3Pogl2Pogl2Pogl2Oh, in z vsemi drugimi alkoholi.
Vam lahko služi: natrijev fosfat: struktura, lastnosti, sinteza, uporabaČe imajo vejo, bo v oklepaju označen desno od atoma, s katero je povezan. Na primer, 2-metilbutanol bi lahko zapisali kot: CH3Pogl2Ch (pogl3) Pogl2Oh. Upoštevajte, da se za številne molekule začne bolj priročno zateči k konstrukcijski ali polrazviti formuli.
Pentano
Pentanov linearni izomer, n-Pentano, enostavno ga je predstavljati za svojo zgoščeno formulo: Cho3Pogl2Pogl2Pogl2Pogl3. To formulo lahko poenostavite tudi z uporabo oklepajev: CH3(Pogl2)3Pogl3, kar kaže na to, da med obema ch3 Obstajajo trije ch2.
Druga dva izomera Pentana pa sta nekoliko bolj zapletena: ch3Pogl2Ch (pogl3)2, Za 2-metilbutana in c (ch3)4 Za 2,2-dimetilpropan ali neopantum. Upoštevajte, da je atom ogljika na levi strani oklepaje tisti, ki tvori povezave do substituentov ali posledic.
Oktan
Linearni izomer oktana, n-Octane je zaradi svoje dolžine zdaj primerno predstavljati svojo zgoščeno formulo kot CHO3(Pogl2)6Pogl3. Na tej točki bi moralo biti nekaj, kar bi bilo treba kondenzirane formule: poskušajo prihraniti čas, ko predstavljajo molekule ali spojine, ne da bi toliko pisali na papir.
Cikloheksan
Primer cikloheksana je podoben kot pri glukozi in fruktozi: formalno nima kondenzirane formule, da bi bila ciklična spojina. Način, kako ga poskusiti zastopati, bi bil: (ch2)6, kar pomeni, da je šest skupin CHO2 Morajo biti povezani, da so možni le, če se zaprejo v šesterokotnem obroču. Vendar je bolje narisati prstan.
Aceton
Aceton predstavlja posebnost posedovanja karbonilne skupine, c = o. Zato imamo za pisanje kondenzirane formule tri možnosti: (ch3)2Co, pogl3C (o) ch3 ali pogl3(C = o) ch3.
Vam lahko služi: kavna kislina: struktura, lastnosti, biosinteza, uporabaPravzaprav je v večjih molekulah karbonilna skupina običajno predstavljena kot (o), ob upoštevanju, da je ogljikov atom na levi strani tisti, ki tvori dvojno vez s kisikom, c = o.
Ocetna kislina
Kondenzirana formula ocetne kisline je CHO3COOH O CH3Co2H. Tu je pomembna točka: funkcionalne skupine, napisane v isti vrstici, so deli zgoščene formule. To je bil primer etanola in acetona in velja tudi za tiole (-sh), aldehidos (-cho)2R o -coor) in amine (-nh2).
Splošni komentar
Med molekularnimi in kondenziranimi formulami je veliko zmede. Morda je to zato, ker samo te predstavitve že zagotavljajo približno podobo molekule, zato menimo, da je to molekularna formula.
Tudi formule, kot je c6H12Tudi6 Prav tako veljajo. Zato je običajno videti, kako sta obe formuli omenjeni, kot da bi bili sinonimi.
V mnogih virih, vključno z članki Wikipedije, se izrazi "kemijska formula" uporabljajo za navajanje molekul (tip C6H12Tudi6 in druge) in "formula", da se nanašajo na kondenzat.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Čelada, Anne Marie, ph.D. (18. november 2019). Opredelitev kondenzirane formule v kemiji. Okreval od: Thoughtco.com
- James Ashenhurst. (11. december 2019). Kondenzirane formule: dešifriranje, kaj pomenijo hrbet. Glavna organska kemija. Okrevano od: mastersorganicChemistry.com
- Copolingenieria. (2. maj 2016). Empirična, strukturna in kondenzacijska formula. Pridobljeno iz: ChemioteCablog.WordPress.com
- Uvod v kemijo: splošna, organska in biološka. (s.F.). Kondenzirane strukturne in linijske formule. Obnovi se od: knjige 2012.Lardbucket.org

