Lastnosti alkil halogenuros, pridobivanje, primeri
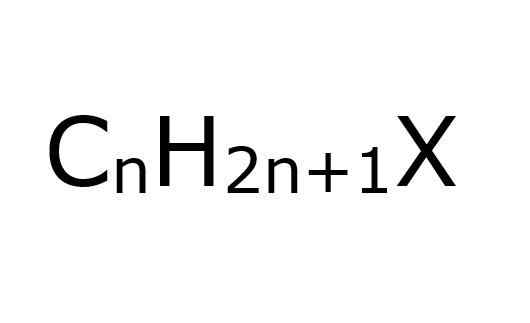
- 2216
- 498
- Raymond Moen
The Alkil halogenuros So organske spojine, v katerih ogljikov atom s hibridizacijo SP3 Halogen je kovalentno povezan (f, cl, br, i). Z druge perspektive je priročno, poenostaviti, domnevati, da so haloalcanos; To so tistim, ki so bili zamenjani nekaj a atomov halogena.
Kot že ime pove, morajo biti halogeni atomi povezani z alkiličnimi skupinami, ki jih je treba upoštevati iz te vrste halogenida; Čeprav jih lahko strukturno zamenjate ali razvejajo in imajo aromatične obroče in še vedno so alkil halogenid.
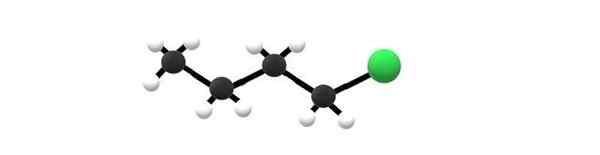 1-klorobutano molekula, primer alkil halogenida. Vir: Gabriel Bolívar.
1-klorobutano molekula, primer alkil halogenida. Vir: Gabriel Bolívar. Zgoraj imate 1-klorobutano molekulo, ki ustreza enemu najpreprostejših alkil halogenidov. Vidimo, da imajo vsi njihovi ogljiki preproste vezi in imajo tudi hibridizacijo SP3. Zato je zelena krogla, ki ustreza atomu CL, povezana s okostjem, ki izhaja iz alkana butana.
Primeri še enostavnejši od 1-klorobutano so tisti, ki izhajajo iz metanskega plina: najmanjši ogljikovodik od vseh.
Iz molekule CHO4 H atomi lahko zamenjate z, recimo, jod. Če je H zamenjan, bo CH3I (jodometan ali metil jodid). Ko se zamenjata dva h, bo CH2Yo2 (Diyodometan ali metilen jodid). Sledil in na koncu zamenjam vse H, ki daje chi3 (jodoform) in ci4 (Carbon tetrayoduro).
Za najem halogenuros je značilno, da so zelo reaktivni in, če ima največ elektronegativnih atomov periodične tabele, je intuitirano, da z mehanizmi simfini vplivajo na biološke matrike.
[TOC]
Lastnosti alkil halogenuros
Lastnosti te družine spojin so odvisne od njegovih molekulskih struktur. Vendar pa v primerjavi s tistimi iz njihovih alkanov opazne razlike, ki jih povzroča preprosto dejstvo, obstajajo povezave C-X (x = halogenski atom).
To pomeni, da so povezave C-X odgovorne za kakršno koli razliko ali podobnost med enim ali več alkil halogenuros.
Za začetek so povezave C-H skoraj apolarne glede na nizko razliko v elektronegativnosti med C in H; Namesto tega imajo povezave C-X trajni dipolski trenutek, ker so halogeni bolj elektronegativni kot ogljik (zlasti fluor).
Po drugi strani so nekateri halogeni lahki (F in CL), drugi pa težki (BR in I). Njegove atomske mase tudi oblikujejo razlike v povezavah C-X; In posledično neposredno v lastnostih halogenida.
Zato je dodajanje halogenov v ogljikovodik enako povečevanju njene polarnosti in molekularne mase; Enako je, da je manj nestanoviten (do neke mere), manj vnetljiv in povečal svoje vrele ali fuzijske točke.
Vrele in fuzijske točke
Zgoraj je prikazano v naraščajočem vrstnem redu velikosti in s tem teža različnih halogenov:
F < Cl < Br < I
Potem se pričakuje, da so alkil halogenidi, ki vsebujejo atome F, lažji od tistih, ki imajo atome BR ali i.
Na primer, nekateri halogenuros, pridobljeni iz metana, veljajo:
Pogl3F < CH3Cl < CH3Br < CH3Yo
Pogl2F2 < CH2Cl2 < CH2Br2 < CH2Yo2
In tako naprej za druge derivacijske produkte višje stopnje halogenacije. Upoštevajte, da se naročilo vzdržuje: fluor halogenuros je lažji od joda. Ne samo to, ampak tudi njegove vrelne in fuzijske točke tudi ubogajo ta naročilo; RF vre pri nižjih temperaturah kot RI (r = cho3, za ta primer).
Vam lahko služi: aromatična elektrofilna substitucija: mehanizem in primeriPrav tako so vse te tekočine brezbarvne, saj v svojih C-X vezi elektroni ne morejo absorbirati ali sprostiti fotonov za potovanje drugih ravni energije. Vendar, ko postanejo težji, lahko kristalizirajo in razkazujejo barve (kot to počne jodoform, chi3).
Polarnost
Povezave C-X se razlikujejo od polarnosti, vendar v obratnem vrstnem redu zgoraj:
C-F> C-Cl> C-BR> C-I
Zato so povezave C-F bolj polarne kot C-I povezave. Ker je bolj polarni, RF halogenuros ponavadi medsebojno deluje prek sil dipole-dipolo. Medtem so v RBR ali RI halogenuros njihovi dipolni trenutki šibkejši in interakcije, ki jih urejajo londonske disperzijske sile, pridobijo večjo moč.
Moč topila
Ker so alkil halogenidi bolj polarni od alkanov, iz katerih izhajajo, povečujejo sposobnost raztapljanja večjega števila organskih spojin. Zaradi tega so ponavadi boljša topila; Čeprav to ne pomeni, da lahko v vseh aplikacijah nadomeščajo alkane.
Obstajajo tehnična, ekonomska, ekološka in merila uspešnosti, da raje halogenirano topilo nad alkanom.
Nomenklatura
Obstajata dva načina za poimenovanje alkil halogenida: po skupnem imenu ali po sistematičnem imenu (IUPAC). Pogosta imena so običajno bolj udobna za uporabo, kadar je RX preprost:
Chcl3
Kloroform: Skupno ime
Metil ali triklorometanski triklorid: ime IUPAC.
Toda sistematična imena so zaželena (in edina možnost), ko imajo razvejane strukture. Ironično je, da so običajna imena spet koristna, kadar so strukture preveč zapletene (na primer tiste, ki jih bomo videli v zadnjem razdelku).
Pravila za poimenovanje spojine v skladu s sistemom IUPAC so enaka za alkohole: identificirana je glavna veriga, ki je najdaljša ali najbolj razvejana. Nato so karboni navedeni na koncu, ki so najbližje nadomestkom ali posledicam, poimenujejo abecedno vrstni red.
Primer
Za ponazoritev imate naslednji primer:
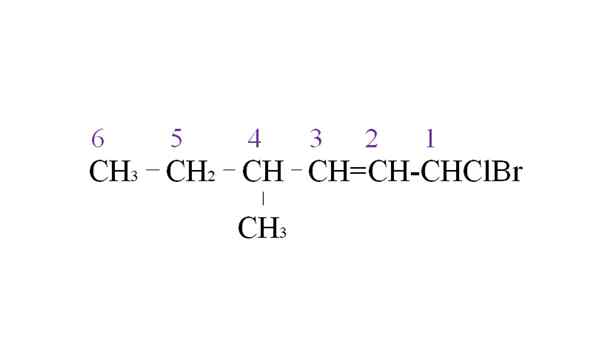 Najem halogenida kot primer nomenklature. Vir: Gabriel Bolívar.
Najem halogenida kot primer nomenklature. Vir: Gabriel Bolívar. Prva veja je metilna skupina v C-4; Toda, če ima dvojna vez ta prej prednostna naloga nad pravilom. Zaradi tega se najdaljša veriga začne uvrstiti z desne, na čelu z ogljikovim atomom, povezanim z dvema halogenama: CL in BR.
Z naštevanjem so substituenti poimenovani po abecednem vrstnem redu:
1-bromo-1-Clor-4-metil-2-heksen.
Pridobivanje
Za pridobitev alkilnih halogenidov je treba molekule predložiti postopku halogenacije; to pomeni, da v svoje strukture vključijo halogenske atome, zlasti v atom v sp a ogljik3.
Obstajata dve metodi za njihovo pridobitev ali sintezo: z ultravijoličnim sevanjem skozi mehanizem prostega radikala ali z dodajanjem hidracestov ali halogenov.
Halogenacija s svetlobnim ali ultravijoličnim sevanjem
Prva, najmanj primerna in z najslabšim donosom, je sestavljena iz obsevanja alkanov z ultravijoličnim sevanjem (Hv) V prisotnosti halogena. Na primer, prikazane so enačbe za kloriranje metana:
Pogl4 + Cl2 => Ch3Cl + HCl (pod ultravijolično svetlobo)
Pogl3Cl + Cl2 => Ch2Cl2 + Hcl
Pogl2Cl2 + Cl2 => Chcl3 + Hcl
Chcl3 + Cl2 => Ccl4 + Hcl
Štiri spojine (ch3Cl, ch2Cl2, Chcl3 in ccl4) Oblikovani so in zato obstaja mešanica, ki jo lahko podvržemo delni destilaciji. Vendar ta metoda ni zelo praktična in raje se zateče k organski sintezi.
Vam lahko služi: fenilacetna kislina: struktura, lastnosti, uporabe, učinkiDrug primer je n-heksanska bromacija:
Pogl3Pogl2Pogl2Pogl2Pogl2Pogl3 + Br2 => Ch3(Br) chch2Pogl2Pogl2Pogl3 + Hbr
Spet se v tej reakciji svetloba ali ultravijolično sevanje uporablja za naklonjenost tvorbi prostih radikalov. Brom, kot je intenzivna rdeča tekočina, je razbarvan, ko reagira, in tako opazi rdečo do barvito barvno spremembo, ko 2-bromoheksan.
Dodajanje hidracestov ali halogenov alkenom
Druga metoda pridobivanja alkil halogenuros je zdravljenje alkoholov (ROH) ali alkenov (r2C = cr2) S hidrace. Hidracidi imajo splošno formulo HX (HF, HCl, HBR in HI). Primer bo prikazan z uporabo etanola za vsakega od njih:
Pogl3Pogl2Oh + hf => ch3Pogl2F + h2Tudi
Pogl3Pogl2Oh + hcl => ch3Pogl2Cl + H2Tudi
Pogl3Pogl2Oh + hbr => ch3Pogl2Br + h2Tudi
Pogl3Pogl2Oh + hi => cho3Pogl2I + h2Tudi
Tudi alkeni lahko dodajo molekule HX v svoje dvojne vezi in tvorijo sekundarni alkil halogenuros.
Pogl2= Ch-ch3 + HBr => BRCH2-Pogl2-Pogl3 + Pogl3-Chbr-ch3
BRCH izdelek2-Pogl2-Pogl3 Je 1-bromopropano in cho3-Chbr-ch3 2-bromopropan. Drugi je večinski izdelek, ker je tisti z največjo stabilnostjo, prvi pa v manjši meri, ker je bolj nestabilen. To je zato, ker CHO3Chbrch3 Je sekundarni alkil halogenid.
Zelo podobno se pojavi, ko je to, kar je dodano alkenu, molekula X2:
Pogl2= Ch-ch3 + Br2 => BRCH2-Chbr-ch3
Vendar pa dobimo alkil halogenid z dvema atomama bromovih, povezanih s sosednjimi ogljikovimi ogljiki; sosedski alkil halogenid. Če bi po drugi strani odvzeli dva Bomosa, povezana z istim ogljikom, bi obstajala geminalni alkil halogenid, kot je naslednje:
Br2Ch-ch2-Pogl3
Reakcije
Nukleofilna substitucija
Reaktivnosti alkilnih halogenidov so v krhkosti ali odpornosti povezave C-X. Težji halogen, šibkejša bo vez, zato se bo lažje zlomila. V kemijskih reakcijskih povezavah so pokvarjene in nastanejo novi; Povezave C-X so pokvarjene, da tvorijo povezavo C-G (G = nova skupina).
V ustreznejših besedah X deluje kot odhajajoča skupina in G kot prihajajoča skupina v reakciji Nukleofilna substitucija. Zakaj se zgodi ta reakcija? Ker je X, ki je bolj elektronegativen kot ogljik, "krade" elektronsko gostoto, ki primanjkuje elektronov, ki prevaja kot pozitivna delna obremenitev:
Cδ+-Xδ-
Če je negativna vrsta okoli bližine (: g-) ali nevtralno s parom elektronov, ki so na voljo (: g), ki lahko tvorijo bolj stabilno povezavo C-G, bo X na koncu zamenjal G. Zgoraj je lahko predstavljeno z naslednjo kemijsko enačbo:
Rx +: g- => Rg + x-
Šibkejša je povezava C-X ali R-X, večja je njegova reaktivnost ali težnjo, da jo nadomestimo Nukleofilno sredstvo (ali nukleofil) g; to pomeni, da ljubitelji jeder ali pozitivnih stroškov.
Primeri
Spodaj je prikazana niz splošnih enačb za nukleofilne substitucije, ki lahko trpijo alkil halogenide:
Rx + oh- => Roh + x- (Alkoholi)
+ Ali'- => Ror' (Ethers, Sinteza Williamsona)
+ Yo- => Ri (alkil joduros)
+ Cn- => Rcn (nitrilos)
+ R'coo- => Rcoor '(ester)
+ Nh3 => Rnh2 (Amini)
+ P (c6H5)3 => RP (c6H5)3+ X- (Fosfonijeve soli)
+ Sh- => Rsh (tioles)
Vam lahko služi: faze kemijeIz teh primerov lahko sumimo na dragocene alkil halogenide za organsko sintezo. Ena od mnogih nadomestkov, ki je manjkala, je reakcija Friedel Crafts, ki je bila uporabljena za "najemo" aromatičnih obročev:
Rx + arh + alcl3 => Rra
V tej reakciji h aromatičnega obroča nadomesti skupino r -od rx.
Izločitev
Najemni halogenidi lahko sprostijo molekule HX z reakcijo izločanja; Konkretno, dehidrohalogenacija:
R2CH-CXR2 + Oh- => R2C = cr2 + Hx
Govori se, da pride do dehidrohalogenacije, ker se v isti molekuli HX izgubita tako H kot X.
Sinteza Grignard reagenta
Najemni halogenidi lahko reagirajo z določenimi kovinami, ki tvorijo Grignardov reagent, ki se uporablja za dodajanje R skupinah drugim molekulam. Splošna enačba njegove sinteze je naslednja:
Rx + mg => rmgx
Primeri
V celotnih odsekih je bilo že omenjenih več primerov alkil halogenuros. Nekateri drugi, preprosti, so:
-Etil klorid, ch3Pogl2Cl
-Izopropil fluoruro, (ch3)2Pogl2F
-2-metil-3-kloropentano, pogl3-Ch (pogl3) -Chcl -ch2Pogl3
-Secbutilo joduro, ch3Pogl2Pogl2I-ch3
-3-bromo-6-orodheptano, pogl3-Pogl2-Chbr-ch2-Pogl2-Pogl2Yo
-3.4-dibromo-1-penteno, pogl3-Chbr-chbr-ch = ch2
Prijave
Topilo
V prejšnjih razdelkih smo uporabili topilno sposobnost alkilnih halogenidov. Iz te nepremičnine jih je industrija izkoristila kot čistila, bodisi za tekstilno snov, elektronske komponente ali odstranilo lastne lise.
Uporabljajo se tudi kot topila slik ali organske ali maščobne vzorce za nešteto tipov analitičnih testov.
Organska sinteza
Najem halogenuros je zelo koristen za "najem" aromatičnih obročev, hkrati pa služi kot začetni vir za sintezo praktično vseh drugih družin organskih spojin. Sintetično se RX šteje za vir skupin ali R verig, ki jih je mogoče zaželeti za vključitev zelo aromatičnih spojin.
Farmacevtska industrija
Na začetku je bilo omenjeno, da halogenski atomi delujejo z biološkimi matricami, zato v naših organizmih ne morejo ostati neopaženo, ne da bi ustvarili spremembo, pozitivne ali negativne. Če zdravilo pozitivno vpliva na telo, se lahko atom halogena, ki učinek lahko ali ne, poveča.
Torej, če je X neposredno povezan z ogljikom s hibridizacijo SP3, Tam bo alkil halogenid in ne halogenirani derivat. Nekateri taki halogenuros so prikazani spodaj v naslednji seriji slik:
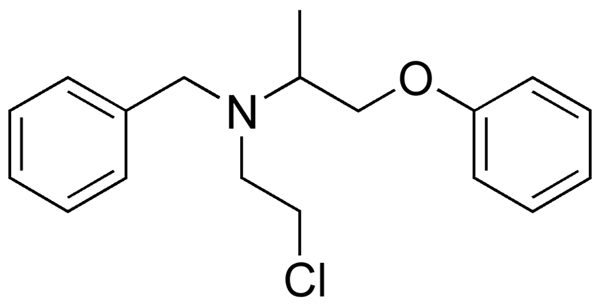 Fenoksibenzamin, zdravilo, ki se uporablja za kombiniranje krvnega tlaka pri bolnikih s feokromocitomom. Vir: Utennt: Mark Pea [javna domena].
Fenoksibenzamin, zdravilo, ki se uporablja za kombiniranje krvnega tlaka pri bolnikih s feokromocitomom. Vir: Utennt: Mark Pea [javna domena].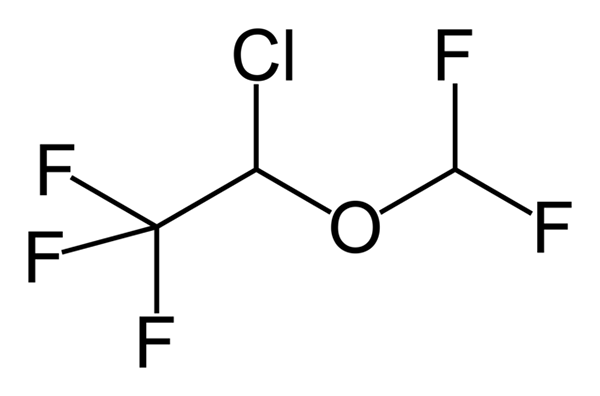 Isoflurano, inhalacijski anestetik. Vir: Benjah-BMM27 [javna domena].
Isoflurano, inhalacijski anestetik. Vir: Benjah-BMM27 [javna domena].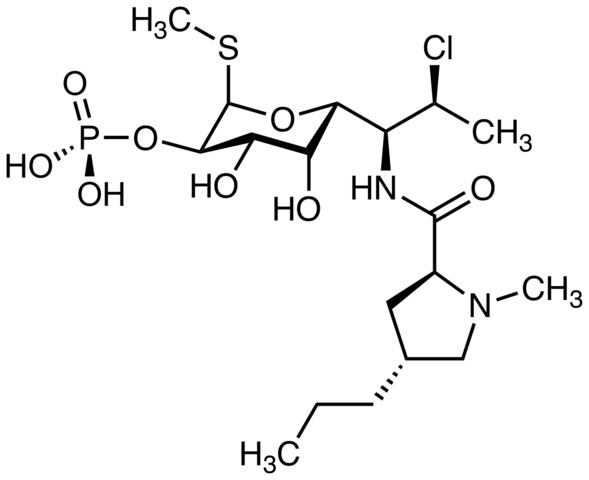 Klindamicin, antibiotik. Vir: M Mitcheltrate [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)].
Klindamicin, antibiotik. Vir: M Mitcheltrate [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)].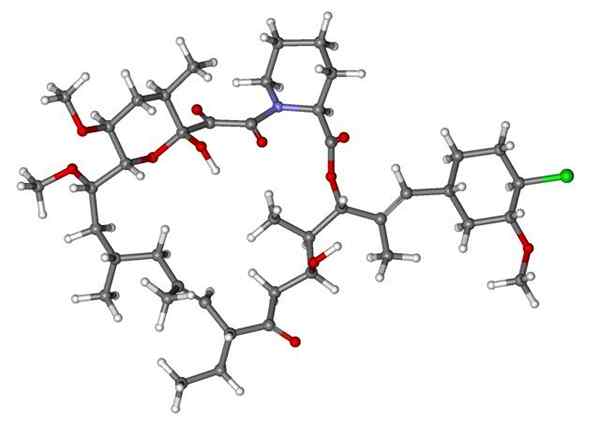 Pimecrolimus, ki se uporablja za zdravljenje atopijskega dermatitisa. Ali lahko najdete atom klora? Vir: Marinavladivok [CC0].
Pimecrolimus, ki se uporablja za zdravljenje atopijskega dermatitisa. Ali lahko najdete atom klora? Vir: Marinavladivok [CC0]. Halomon, možno protitumorsko sredstvo in alkil halogenid morskih alg Portieria hornemannii, naravni vir. Vir: Jü [javna domena]
Halomon, možno protitumorsko sredstvo in alkil halogenid morskih alg Portieria hornemannii, naravni vir. Vir: Jü [javna domena]
Upoštevajte, da v teh petih zdravilih obstaja vsaj ena povezava tipa CHO2-X ali ch-x; To pomeni, da je halogen povezan s sp -karbonom3.
Hladilna sredstva
Znano hladilno sredstvo Freón-12 (chcif2), Tako kot drugi fluoroalcanos ali ogljikovodike, so v tej funkciji zamenjali amoniak in klorofluoroogljikovodike (CFC), ker so tudi zaradi ne -prolatilne ali strupene snovi uničili ozonski sloj; Medtem ko je Freón-12, ker je bolj reaktiven, uničen, preden doseže takšne višine.
Reference
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Clark Jim. (14. julij 2016). Uporaba alkilnih halidov. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Gál, b., Bucher, c., & Burns, n. Z. (2016). Kiralni alkilni halogenidi: neobdelani motivi v medicini. Morska zdravila, 14 (11), 206. Doi: 10.3390/MD14110206
- Alkil halogenidi. Pridobljeno od: chemed.Kem.Purdue.Edu
- Patkar Prachi. (16. julij 2017). Vse o alkil halogenidi: lastnosti, uporabi in še veliko več. Znanstvena struktura. Okrevano od: ScienceStruck.com
- R. ladja. (2016). Alkil halogenidi. Okrevano od: hiperfizika.PHY-ASST.GSU.Edu
- Vodnik za učenje za poglavje 9 - Alkil Haloge I. Okrevano od: kaktus.Dixie.Edu
- Q.Do. Eduardo Vega Barrios. (s.F.). Najem halogenuros: nepremičnine, uporabe in prijave. [PDF. Obnovljeno od: cvonline.Uaeh.Edu.mx
- « Struktura dušika (HNO2), lastnosti, sinteza
- Litijeva bromidna struktura, lastnosti, uporabe, tveganja »

