Litijeva bromidna struktura, lastnosti, uporabe, tveganja
- 3177
- 622
- Adrian Legros
On Litijev bromid To je nevtralna sol alkalne kovine, katere kemijska formula je Libr. Formula izraža, da je njegova kristalna trdna snov sestavljena iz Li ionov+ in br- V razmerju 1: 1. Vaši kristali so beli ali svetlo bež. V vodi je zelo topen in tudi precej higroskopska sol.
Ta zadnja lastnost omogoča njegovo uporabo kot sušilnico v sistemih za klimatsko napravo in hlajenje. Prav tako je bil od začetka 20. stoletja uporabljen litijev bromid pri zdravljenju nekaterih motenj duševnega zdravja, pri čemer je opustil njegovo uporabo zaradi neprimerne uporabe soli.
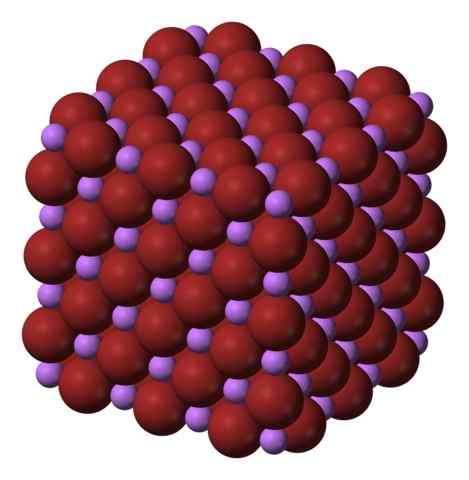
 Kubična kristalna struktura Libr. Vir: Benjah-BMM27 prek Wikipedije.
Kubična kristalna struktura Libr. Vir: Benjah-BMM27 prek Wikipedije. LEBR nastaja z zdravljenjem litijevega karbonata, li2Co3, z bromhirijsko kislino. Po segrevanju medija obori v vodni raztopini kot hidrat.
Ta sol draži kožo in oči s stikom, medtem ko z vdihavanjem proizvaja draženje dihalnih kanalov. Vnos litijevih soli lahko povzroči slabost, bruhanje, drisko in omotico.
[TOC]
Struktura litijevega bromida
Formula Libr jasno pove, da je delež li/br enak 1; Za vsako kation li+ Obstajati mora BRanion- kolega. Zato mora biti ta delež konstanten v vsakem kotičku kristala.
Ioni li+ in br- Privabljajo se drug drugega in zmanjšujejo odboj med enakimi obremenitvami, da bi povzročili kubično kristalno vrsto dragulja; To je izomorfno do NACL (Superior Slika). Upoštevajte, da ima celoten komplet kubično geometrijo.
V tem kristalu, li+ So manjši in imajo lahko vijolično barvo; medtem ko Br- So bolj zajetne in intenzivne rjave barve. Opažamo, da ima vsak ion šest sosedov, kar je isto kot pravi, da predstavljajo oktaedrsko koordinacijo: listnik6 ali li6Br; Če pa upoštevamo enotno celico, delež LI/BR ostane 1.
Vam lahko služi: kristalna strukturaTo je kristalna struktura, ki jo je prednostno sprejel LEBR. Vendar lahko tvori tudi druge vrste kristalov: wurzita, če kristalizira pri nizkih temperaturah (-50 ° C) na podlagi; o kubični osredotočen na telo ali tip CSCL, če je kubična steklena sol pod visokim pritiskom.
Hidrati in steklo
Zgoraj je uporabno za knjižnico. Ta sol je higroskopska in zato lahko absorbira vlago okolja, ki prepleta molekule vode v svoje kristale. Tako nastanejo libr · nh hidrati2Ali (n = 1, 2, 3 ..., 10). Za vsak hidrat je kristalna struktura drugačna.
Na primer, kristalografske študije so ugotovile, da je libr · h2Ali sprejeti strukturo tipa Perovskita.
Ko so ti hidrati v vodni raztopini, se lahko prelivajo in vitrirajo; To pomeni, da sprejmejo kristalno, a molekularno moteno strukturo. V takšnih pogojih postanejo mostovi vodni vodik precej pomembni.
Lastnosti
Molekularna teža
88.845 g/mol.
Videz
Bela kristalna trdna ali svetlo bež.
Vonj
Stranišče.
Tališče
552 ° C (1.026 ° F, 825 K).
Vrelišče
1.256 ° C (2.309 ° F, 1.538 K).
Topnost vode
166,7 g/100 ml pri 20 ° C. Upoštevajte svojo visoko topnost.
Topnost v organskih topilih
Topno v metanolu, etanolu, etru in acetonu. Rahlo topen v piridinu, aromatični spojini in manj polarni kot prejšnji.
Indeks loma (ηD)
1.784.
Kalorična zmogljivost
51,88 j/mol · k.
Standardna molarna entropijaθ 298)
66,9 j/mol · k.
točka vžiga
1.265 ° C. Se šteje za ne -vnetljivo.
Stabilnost
Stabilno. Oblika anhidra pa je izjemno higroskopska.
Razgradnja
Ko se razpade s segrevanjem, povzroči litijev oksid.
Vam lahko služi: klorogena kislinaph
Med pH 6 in 7 v vodni raztopini (100 g/L, 20 ° C).
Reaktivnost
Litijev bromid ni reaktiven v normalnih okoljskih pogojih. Vendar lahko doživite intenzivne reakcije z močnimi kislinami, ko se temperatura zviša.
Pri raztapljanju v vodi pride do zvišanja temperature, ki jo povzroči negativna entalpija hidracije.
Proizvodnja
LEBR se pojavi z reakcijo litijevega hidroksida ali litijevega karbonata z bromhirično kislino v reakciji nevtralizacije:
Li2Co3 + Hbr => lirb +co2 + H2Tudi
Litijev bromid dobimo kot hidrat. Za pridobitev brezvodne oblike je treba segrevati hidrirano sol pod vakuumom.
Nomenklatura
Ime "litijev bromid" izhaja iz kovinskega halogenida, imenovanega po nomenklaturi zalog. Druga imena, enako veljavna, vendar manj uporabljena, so litijeva monobromure, v skladu s sistematično nomenklaturo; in litični bromid (edinstvena valenca +1 za litij), v skladu s tradicionalno nomenklaturo.
Prijave
Sušilnice
LEBR je higroskopska sol, ki tvori koncentrirano slanico, ki lahko absorbira vlago zraka v širokem razponu temperatur. Ta slanica se uporablja kot sušilka v sistemih za klimatsko napravo in hlajenje.
Vlakna
Uporablja se za povečanje količine volne, las in drugih organskih vlaken.
Farmacevtski adukti
LEBR tvori addukte z nekaterimi farmacevtskimi spojinami, ki modulirajo njegovo delovanje. Addukt je kombinacija z usklajevanjem dveh ali več molekul, brez strukturne spremembe katere koli od Združenih molekul.
Sedativno
Litijev bromid je bil uporabljen na začetku kot sedativ pri določenih duševnih motnjah, nehaj uporabljati leta 1940. Trenutno se uporablja litijev karbonat; Vsekakor pa je litij element, ki izvaja terapevtsko delovanje v obeh spojinah.
Lahko vam služi: Plumbumse Oxid (PBO): formula, lastnosti, tveganja in uporabeLitij se uporablja pri zdravljenju bipolarne motnje, ki je bil koristen pri nadzoru maničnih epizod motnje. Menijo, da litij zavira aktivnost ekscitacijskih nevrotransmiterjev, kot sta dopamin in glutaminska kislina.
Po drugi strani se aktivnost zaviralnega sistema, ki ga posreduje nevrotransmiter gama-amino-buterično kislino (GABA), poveča (GABA). Ta dejanja bi lahko bila del terapevtskega delovanja litija.
Tveganja
Kontaktna strupenost
Kožno draženje in preobčutljivost, alergije. Resne poškodbe oči ali draženje oči, na dihalnem traktu, nosnici in grlu.
Zaužitje
Glavni simptomi zaradi vnosa litijevega bromida so: prebavne motnje, bruhanje in slabost. Drugi škodljivi učinki na zaužitje soli vključujejo vznemirjenje, krče in izgubo zavesti.
Stanje, znano kot "bromizem", se lahko pojavi z odmerkom litijevega -bbromida, večjega od 225 mg/dan.
V bromizmu lahko pride do naslednjih simptomov in znakov: poslabšanje aken in izguba apetita, tresenja, težav z govorom, apatijo, šibkost in manijakalno vznemirjenostjo.
Reference
- Kemična formulacija. (2019). Litijev bromid. Obnovi se od: quimica formulacije.com
- David c. Johnson. (10. julij 2008). Novo naročilo za litijev bromid. Narava. doi.org/10.1038/454174A
- Aayushi Jain & R.C. Dixit. (s.F.). Strukturni fazni prehod v litijevem bromidu: Vpliv tlaka in temperature. [PDF]. Okrevano od: NCPCM.v
- Takamuku in sod. (1997). Študije rentgenskih diffrakcij na raztopinah vodnega litijevega bromida in litijevega jodida. Oddelek za kemijo, Znanstvena fakulteta, Univerza Fukuoka, Nanakuma, Jonan-ku, Fukuoka 814-80, Japonska.
- Nacionalni center za informacije o biotehnologiji. (2019). Litijev bromid. Baza podatkov Pubchem, CID = 82050. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- Wikipedija. (2019). Litijev bromid. Pridobljeno iz: v.Wikipedija.org
- Royal Society of Chemistry. (2019). Litijev bromid. Chemspider. Okreval od: chemspider.com
- « Lastnosti alkil halogenuros, pridobivanje, primeri
- Mehika v dejanjih iz 18. stoletja in socialno -ekonomskih sprememb »

