Struktura dušika (HNO2), lastnosti, sinteza

- 2146
- 163
- Don Nitzsche
On dušikova kislina Gre za šibko, anorgansko kislino, katere kemična formula je hno2. V bistvu je v vodni raztopini z bledo modro obarvanostjo. Je zelo nestabilen in se hitro razbije na dušikov oksid, ne in v dušikovo kislino, ino3.
Običajno je v vodni raztopini v obliki nitritov. Seveda izhaja tudi iz atmosfere kot posledica reakcije dušikovega oksida z vodo. Tam, zlasti v troposferi, dušikova kislina posega v regulacijo koncentracije ozona.
 Raztopina dušika kisline v čaši. Vir: Noben strojno berljiv avtor. Je domneval nori znanstvenik ~ commonswiki (na podlagi zahtevkov za avtorske pravice). [Javna domena]
Raztopina dušika kisline v čaši. Vir: Noben strojno berljiv avtor. Je domneval nori znanstvenik ~ commonswiki (na podlagi zahtevkov za avtorske pravice). [Javna domena] Na zgornji sliki je prikazana raztopina HNO2 kjer je mogoče videti značilno bledo modro barvo te kisline. Sintetizira se z raztapljanjem dušikovega trioksida, n2Tudi3, V vodi. Prav tako je produkt zakisanja raztopin natrijevega nitrita pri nizkih temperaturah.
Hno2 Ima malo komercialne uporabe, ki uporablja v obliki nitrita pri ohranjanju mesa. Po drugi strani se uporablja pri izdelavi azojskih barvil.
Uporablja se skupaj z natrijevim tiosulfatom pri zdravljenju bolnikov z zastrupitvijo natrijevega cianida. Toda to je mutageno sredstvo in misli se, da lahko povzroči substitucije v bazah verig DNK z oksidativno deaminacijo citozina in adenina.
Dušika kislina ima dvojno vedenje, saj se lahko obnaša kot oksidativno sredstvo ali kot reducirajoče sredstvo; to pomeni, da ga je mogoče zmanjšati na no ali n2, oksidirajte3.
[TOC]
Struktura dušikove kisline
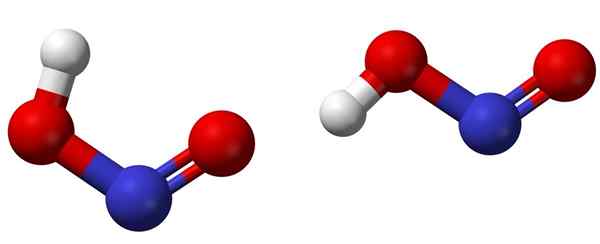 Cis (levo) in trans (desno) izomera z ustreznimi molekularnimi strukturami HNO2. Vir: Ben Mills [javna domena].
Cis (levo) in trans (desno) izomera z ustreznimi molekularnimi strukturami HNO2. Vir: Ben Mills [javna domena]. Zgornja slika prikazuje molekularno strukturo dušikove kisline s pomočjo modela kroglic in palic. Dušikov atom (modra krogla) se nahaja v središču konstrukcije, ki tvori dvojno vez (n = o) in preprost (n-o) z atomi kisika (rdeča krogla).
Upoštevajte, da je atom vodika (bela krogla) povezan z enim od kisika in ne neposredno z dušikom. Torej, vedoč, strukturna formula hno2 Je [ho-n = o] ali [ne (OH)] in takšne povezave H-N ni (kot si lahko misli kemična formula).
Molekule slike ustrezajo tistim iz plinske faze; V vodi jih obdajajo molekule vode, ki lahko sprejmejo vodikov ion (šibko), da tvorijo ione ne2- in h3Tudi+.
Vam lahko služi: čašaNjegove strukture lahko sprejmejo dve obliki: cis ali trans, imenovani geometrijski izomeri. V cis izomerju je atom H zasenčen s sosednjim atomom kisika; Medtem ko je v transomerju, oba najdemo v protipopolnih položajih.
V cis izomerju je verjetno tvorba intramolekularnega vodika (OH-NO), ki lahko uvozi medmolekularno (Onoh-Onoh).
Lastnosti
Kemična imena
-Dušikova kislina
-Dioksonitrična kislina (III)
-Nitrozilni hidroksid
-Hidroksideoksidonitrogen (sistematično ime IUPAC)
Fizični opis
Bledo modra tekočina, ki ustreza raztopini nitrita.
Molekularna teža
47.013 g/mol.
Konstanta disociacije
Je šibka kislina. Njegov PKA je 3,35 do 25 ° C.
Tališče
Je znan le v rešitvi. Zato vaših tališč ni mogoče izračunati, niti vaših kristalov ni mogoče izolirati.
Vrelišče
Če ne obstoječi čisti, ampak v vodi, meritve te lastnosti niso natančne. Po eni strani je odvisno od koncentracije hno2, In po drugi segrevanje povzroči njegovo razgradnjo. Zato se ne poroča natančno vrelišče.
Prodajna ustanova
Topne vode -topni nitriji z li+, Na+, K+, AC2+, gospod2+, Ba2+. Vendar ne tvorite soli z vsestranskimi kationi, kot so: do3+ in/ali biti2+ (zaradi velike gostote obremenitve). Lahko tvori stabilne estre z alkoholi.
Požarni potencial
Je vnetljivo za kemične reakcije. Lahko eksplodira s stikom s fosforjevim trikloridom.
Razgradnja
Je zelo nestabilna spojina in v vodni raztopini se razgradi v dušikovega oksida in dušikove kisline:
2 hno2 => Ne2 + Št +h2Tudi
4 hno2 => 2 hno3 + N2Ali +h2Tudi
Zmanjšanje sredstva
Dušikova kislina v vodni raztopini je predstavljena v obliki nitritnih ionov, ne2-, ki doživljajo več reakcij redukcije.
Reagira z ioni i- in vera2+, V obliki kalijevega nitrita, da tvori dušikov oksid:
2 kno2 + Ki +h2SW4 => I2 + 2 št +2 h2Ali +k2SW2
Kalijev nitrit v prisotnosti kositrnih ionov se zmanjša na dušikovo oksid:
Kno2 + 6 HCl +2 sncl2 => 2 sncl4 + N2O +3 h2O +2 kCl
Vam lahko služi: Beryl hidroksid (biti (OH) 2)Kalijev nitrit zmanjša Zn v alkalnem okolju, ki tvori amoniak:
5 h2O +kno2 + 3 Zn => nh3 + Koh +3 Zn (OH)2
Oksidacijsko sredstvo
Poleg tega, da je reducirajoče sredstvo, lahko dušikova kislina poseže v procese oksidacije. Na primer: oksidirajte do vodikovega sulfida, postanete dušikov ali amonijski oksid, odvisno od kislosti medija, v katerem se pojavi reakcija.
2 hno2 + H2S => s +2 št +2 h2Tudi
Hno2 + 3 h2S => s +nh3 + 2 h2Tudi
Dušika kislina v kislih pH mediju lahko oksidira jodid ion do joda.
Hno2 + Yo- + 6 h+ => 3 I2 + Nh3 + 2 h2Tudi
Lahko delujete tudi kot reducirajoči agent, ki deluje na CU2+, povzroča dušikovo kislino.
Nomenklatura
Do hno2 Lahko daste druga imena, ki so odvisna od vrste nomenklature. Dušika kislina ustreza tradicionalni nomenklaturi; dioksonitrična kislina (III), za nomenklaturo zalog; in dioksonitrat (III) vodika, sistematičnosti.
Sinteza
Dušikova kislina se lahko sintetizira z raztapljanjem dušikovega trioksida v vodi:
N2Tudi3 + H2O => 2 hno2
Druga metoda priprave je reakcija natrijevega nitrita, nano3, z mineralnimi kislinami; kot sta klorovodikova kislina in bromhirijska kislina. Reakcija se izvede pri nizki temperaturi in dušikova kislina porabi in situ.
Starejši brat3 + H+ => Hno2 + Na+
H+ Prihaja bodisi iz HCL ali HBR.
Tveganja
Glede na njegove kemijske lastnosti in značilnosti je malo informacij o neposrednih strupenih učinkih HNO2. Morda nekaj škodljivih učinkov, za katere verjame, da jih povzroča ta spojina, dejansko povzroči dušikova kislina, ki se lahko pojavijo z razpadom dušikove kisline.
Poudarjeno je, da hno2 Lahko ima škodljive učinke na dihalne poti in lahko pri astmatičnih bolnikih povzroči simptome draženja.
V obliki natrijevega nitrita ga zmanjša deoksihemoglobin, ki proizvaja dušikov oksid. To je močan vazodilatator, ki povzroči sprostitev žilnih gladkih mišic, pri ljudeh pa oceni odmerek LD50 35 mg/kg za oralno porabo.
Toksičnost natrijevega nitrita se manifestira s kardiovaskularnim propadom, ki ji sledi huda hipotenzija zaradi vazodilatatorskega delovanja dušikovega oksida, proizvedenega iz nitrita.
Dušikov dioksid, št2, Prisoten v onesnaženem zraku (smog), pod določenimi pogoji lahko povzroči dušikovo kislino; ki lahko reagira z amini, da tvori nitrozamin, gama rakotvornih spojin.
Lahko vam postreže: srebrni oksid (Ag2O)Podobna reakcija se pojavi pri dimu cigaret. Najdeni so bili nitrozaminski ostanki, ki so se držali notranje obloge kajenja vozil.
Prijave
Proizvodnja prodaje diazonije
Dušika kislina se v industriji uporablja pri proizvodnji diazonijevih soli s svojo reakcijo z aromatičnimi amini in fenoli.
Hno2 + Rnah2 + H+ => RNA = nar +h2Tudi
Diazonijeve soli se uporabljajo v reakcijah organske sinteze; Na primer v Sandmeyerjevi reakciji. V tej reakciji pride do zamenjave amino skupine (h2N-), v primarnem aromatičnem aminu s pomočjo CL skupin-, Br- in CN-. Za pridobitev teh aromatičnih izdelkov so potrebne coupro soli.
Diazonijeve soli lahko tvorijo briljantne strešne spojine, ki se uporabljajo kot barvila in služijo tudi kot kvalitativni test za odkrivanje prisotnosti aromatičnih aminov.
Eliminacija natrijeve azide
Dušika kislina se uporablja za odpravo natrijevega azida3), kar je potencialno nevarno za njegovo težnjo po izkoriščanju.
2 nan3 + 2 hno2 => 3 n2 + 2 Ne +2 NaOH
Sinteza oksim
Dušika kislina lahko reagira s ketonskimi skupinami, da tvori oksime. Te lahko oksidiramo tako, da tvorijo karboksile ali zmanjšano kislino, da povzročijo amin.
Ta postopek se uporablja pri komercialni pripravi adipične kisline, monomera, ki se uporablja v proizvodnji najlona. Prav tako posega v proizvodnjo poliuretana, njegovi estri pa so mehčalci, predvsem v PVC.
Pod svojo fiziološko obliko
Dušika kislina v obliki natrijevega nitrita se uporablja pri zdravljenju in ohranjanju mesa; Ker preprečuje rast bakterij in lahko reagira z mioglobinom, kar ustvarja temno rdečo barvo, zaradi katere je meso privlačnejše za uživanje.
Ta ista sol se uporablja, skupaj z natrijevim tiosulfatom, pri intravenskem zdravljenju zastrupitve natrijevega cianida.
Reference
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. Amine. (10th Izdaja.). Wiley Plus.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Pubchem. (2019). Dušikova kislina. Okrevano od: pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov
- SoftSchools. (2019). Dušikova kislina. Okrevano od: softschools.com
- Wikipedija. (2019). Dušikova kislina. Pridobljeno iz: v.Wikipedija.org
- Royal Society of Chemistry. (2015). Dušikova kislina. Okreval od: chemspider.com
- Enciklopedija New World. (2015). Dušikova kislina. Okrevano od: Newworldiklopedija.org
- Droge. (2019). Dušikova kislina. Okrevano od: drogebank.AC
- Kemična formulacija. (2018). Hno2. Obnovi se od: quimica formulacije.com
- « Številke ali kazalniki, ki govorijo o izobraževalnem napredku v državi
- Lastnosti alkil halogenuros, pridobivanje, primeri »

