Struktura kalcijevega fluorida (CAF2), lastnosti, uporabe

- 1297
- 294
- Adrian Legros
On Kalcijev fluorid Gre za anorgansko trdno snov, ki jo tvori kalcijev atom (CA) in dva atoma fluora (F). Njegova kemična formula je CAF2 In je kristalno siva -bela trdna trdna.
V naravi ga najdemo v fluoritni rudi ali škropljenju. Naravno obstaja v kosteh in zobeh. Fluoritni mineral je glavni vir, ki se uporablja za pridobivanje drugih fluorovih spojin.
 CAF kalcijev fluorid2 trden. W: Uporabnik: Walkerma junija 2005. Vir: Wikimedia Commons.
CAF kalcijev fluorid2 trden. W: Uporabnik: Walkerma junija 2005. Vir: Wikimedia Commons. Poleg tega kava2 Uporablja se za preprečevanje kariesa v zobeh, zato se dodajo materialom, ki jih zobozdravniki uporabljajo za njihovo ozdravitev. Dejansko se kalcijevi fluorid doda tudi v pitno vodo (voda, ki jo je mogoče piti), tako da populacija koristi pri zaužitju in ščetkanju zob.
Caf2 Uporablja se v velikih kristalih v optični opremi in kamerah. Uporablja se tudi v majhnih napravah, ki služijo zaznavanju, koliko je oseba izpostavljena radioaktivnosti.
[TOC]
Struktura
CAF kalcijev fluorid2 Gre2+ in dve fluoridi-. Vendar nekateri viri informacij kažejo, da imajo njihove povezave določen kovalenten značaj.
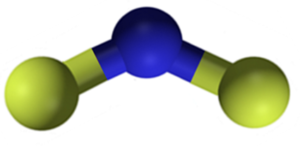 Struktura kalcijevega fluorida CAF2. Modra: kalcij; Rumeni fluor. Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons.
Struktura kalcijevega fluorida CAF2. Modra: kalcij; Rumeni fluor. Claudio Pistilli [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons. Nomenklatura
Kalcijev fluorid
Lastnosti
Fizično stanje
Barvanje trdno do sivkasto belo s kubično kristalno strukturo.
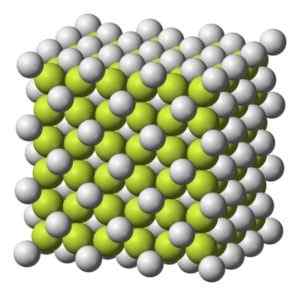 Kubična kristalna struktura kave2. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons.
Kubična kristalna struktura kave2. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons. Molekularna teža
78,07 g/mol
Tališče
1418 ° C
Vrelišče
2533 ° C
Gostota
3.18 g/cm3 pri 20 ° C.
Lomni količnik
1.4328
Topnost
Je netopna v vodi pri 20 ° C. Skoraj netopna pri 25 ° C: 0,002 g/100 ml vode. Rahlo topno topno.
Kemične lastnosti
Njegove oksidacijske ali zmanjševanje lastnosti so zelo šibke, vendar se te reakcije lahko pojavijo. Čeprav običajno v zelo malo primerih.
Je inerten za organske kemijske spojine in veliko kislin, vključno s fluorhorično kislino HF. Počasi se raztopi v dušikovi kislini3.
Vam lahko služi: Millikan Experiment: postopek, razlaga, pomenNi vnetljivo. Ne reagira hitro z zrakom ali vodo.
Zaradi majhne naklonjenosti vode, čeprav je izpostavljen visokemu odstotku vlage, nanj ne vpliva niti na mesec pri običajni sobni temperaturi.
V prisotnosti vlage se stene njihovih kristalov počasi raztopijo pri temperaturah nad 600 ° C. V suhih okoljih ga lahko uporabite do približno 1000 ° C brez občutno prizadetih.
Prisotnost v naravi
CAF kalcijev fluorid2 Seveda ga najdemo v fluoritni rudi ali škropljenju fluorida.
Čeprav kava2 Čista je brezbarvna, fluoritni mineral je pogosto obarvan s prisotnostjo elektronov, ujetih v "luknjah" kristalne strukture.
Ta mineral je zelo cenjen zaradi svoje steklene svetlosti in raznolikosti barv (vijolična, modra, zelena, rumena, brezbarvna, rjava, roza, črna in rdečkasta oranžna). Pravijo, da je "najbolj obarvan mineral na svetu".
 Fluorit rudnika v Franciji. Toulouse Muséum [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
Fluorit rudnika v Franciji. Toulouse Muséum [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons. Fluorit (modri kristali) Naravnega muzeja Milana. Giovanni Dall'orto [cc by-sa 2.5 IT (https: // creativeCommons.Org/licence/by-sa/2.5/IT/Deed.v)]. Vir: Wikimedia Commons.
Fluorit (modri kristali) Naravnega muzeja Milana. Giovanni Dall'orto [cc by-sa 2.5 IT (https: // creativeCommons.Org/licence/by-sa/2.5/IT/Deed.v)]. Vir: Wikimedia Commons. Fluorit rudnika v Angliji. Didier Descuens [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons.
Fluorit rudnika v Angliji. Didier Descuens [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons. Fluorit rudnika v Franciji. Didier Descuens [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
Fluorit rudnika v Franciji. Didier Descuens [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
 Fluorit rudnika v ZDA. Avtor: Oliveira Jurema. Vir: Wikimedia Commons.
Fluorit rudnika v ZDA. Avtor: Oliveira Jurema. Vir: Wikimedia Commons. Kalcijev fluorid najdemo tudi v kosteh v količinah med 0,2 in 0,65%in tudi v sklenini zob v 0,33-0,59%.
Prijave
- Pri pridobivanju fluoridnih spojin
Fluorita Caf2 Je osnovni ali večinski vir fluorida po vsem svetu. Surovina je, da pripravi skoraj vse fluorirane spojine.
Najpomembnejša od njih je HF fluorhorhorhorhorhorhor, iz katere so pripravljene druge flukcijske spojine. Fluoridni ion f- Iz minerala se sprosti z reakcijo tega s koncentrirano žveplovo kislino H2SW4:
Vam lahko služi: IsomeriaCaf2 (trdno) + h2SW4 (tekočina) → primer4 (trdna) + 2 HF (plin)
- V oskrbi zob
CAF kalcijev fluorid2 Je agent za preprečevanje kariesa. Uporablja se za fluorizacijo pitnih voda (vode, ki jih lahko pijejo) s tem ciljem.
Poleg tega nizke koncentracije fluorida f- (vrstnega reda 0,1 delov na milijon), ki se uporabljajo v zobnih pastah in izpiranju ust.
 Kalcijev fluorid pomaga pri preprečevanju kariesa. Avtor: Annalize Batista. Vir: Pixabay.
Kalcijev fluorid pomaga pri preprečevanju kariesa. Avtor: Annalize Batista. Vir: Pixabay. CAF nanodelci2 učinkovitejši
Čeprav se fluoridi uporabljajo v zobnih pastah in izpiranju, nizka koncentracija kalcija (CA) v slini povzroči nahajališča kave2 v zobeh na najbolj učinkovit način.
Zato je bil zasnovan način za pridobitev kavnega prahu2 kot nanodelci.
Za to rocío uporablja sušilnik (iz angleščine Razpršilec) Kjer dve rešitvi (ena od Ca (OH) kalcijevega hidroksida2 in eden od amonijevega fluorida NH4F) Mešajo, medtem ko so razpršeni v kamero z vročim pretokom zraka.
Potem pride do naslednje reakcije:
CA (OH)2 + Nh4F → CAF2 (trdno) + NH4Oh
NH4Oh hlapnira kot NH3 in h2O in nanodelci CAF ostanejo2.
Ti imajo visoko reaktivnost in večjo topnost, zaradi česar so bolj učinkovite za seineralizacijo zob in kot antikariji.
- V objektivu za optično opremo
Kalcijev fluorid se uporablja za izdelavo optičnih elementov, kot so prizme in spektrofotometri infrardeče in ultravijolične svetlobe (UV).
Te naprave omogočajo merjenje količine svetlobe, ki jo absorbira material, ko gre skozi njega.
Caf2 V teh regijah spektra svetlobe je prozoren, ima izjemno nizek indeks loma in omogoča pridobitev učinkovitejše ločljivosti kot pri NACL v intervalu 1500-4000 cm-1.
Vam lahko služi: paramagnetizemZahvaljujoč svoji kemični stabilnosti lahko podpira neugodne razmere, tako da optični elementi CAF2 Ne napadajo. Ima tudi visoko trdoto.
V kamerah
Nekateri proizvajalci kamer uporabljajo leče za kavo2 umetno kristalizirano za zmanjšanje svetlobne disperzije in doseganje odlične popravke izkrivljanja barv.
 Nekatere kamere imajo leče CAF kalcijevega fluorida2 Za zmanjšanje izkrivljanja barv. Bill Ebbesen [CC do 3.0 (https: // creativeCommons.Org/licence/by/3.0)]. Vir: Wikimedia Commons.
Nekatere kamere imajo leče CAF kalcijevega fluorida2 Za zmanjšanje izkrivljanja barv. Bill Ebbesen [CC do 3.0 (https: // creativeCommons.Org/licence/by/3.0)]. Vir: Wikimedia Commons. - V metalurški industriji
Caf2 Uporablja se kot ustanovno sredstvo v metalurški industriji, ker je vir kalcija, ki nitostana v vodi in je zato učinkovit v kisiku, občutljivih.
Uporablja se za taljenje in predelavo železa in jekla. To temelji na dejstvu, da ima tališče, podobno kot železo, in tudi, da lahko raztopi okside in kovine.
- V radioaktivnih detektorjih ali nevarnem sevanju
Caf2 Je termoluminiscenčni material. To pomeni, da lahko absorbira sevanje v elektronih svoje kristalne strukture in nato, ko se segreje, da ga sprosti v obliki svetlobe.
To oddajanje lahko merimo z električnim signalom. Ta signal je sorazmeren s količino sevanja, ki ga dobi material. Pomeni, da večja kot je količina sevanja, večja je količina svetlobe, ki se bo pozneje oddajala.
Zato kaf2 Uporablja se v tako imenovanih osebnih dvometrih, ki jih uporabljajo ljudje, ki so izpostavljeni nevarnim sevanjem in želite vedeti, koliko sevanja so prejeli v določenem času.
- Druge uporabe
- Uporablja se kot katalizator v kemičnih reakcijah dehidracije in dehidrogenacije za sintezo organskih spojin.
- Uporablja se v alkalnih elektrodah varjenja. Dobimo močnejše varjenje kot s kislimi elektrodami. Te elektrode so uporabne pri proizvodnji ladij in posode z visokotlačnim jeklenim zabojnikom.
- Kot prehrambeno dopolnilo v izjemno nizkih količinah (ppm ali deli na milijon).
 Moško varjenje. Elektrode s kavo kalcijeve fluoride2 Tvorijo močnejše zvare. William m. Plošča jr. [Javna domena]. Vir: Wikimedia Commons.
Moško varjenje. Elektrode s kavo kalcijeve fluoride2 Tvorijo močnejše zvare. William m. Plošča jr. [Javna domena]. Vir: Wikimedia Commons. Reference
- Pirmadian, m. in Hooshmand, t. (2019). Remineralizacija in antibakterijske zmogljivosti zobnih nanokompozitov na osnovi smole. Sinteza in karakterizacija kalcijevega fluorida (CAF2). Pri uporabi nanokompozitnih materialov v zobozdravstvu. Okrevano od Scientirect.com.
- Ali.S. Nacionalna knjižnica medicine. (2019). Fluoridski kalcij. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Weman, k. (2012). Varjenje kovinskega loka (MMA) s prevlečanimi elektrodami. V priročniku za varjenje (druga izdaja). Okrevano od Scientirect.com.
- Hanning, m. in Hanning, c. (2013). Nanobiomateriali v preventivni zobozdravstvu. Nanozizirani fluoridni kalcij. V nanobiomaterialih v klinični zobozdravstvu. Okrevano od Scientirect.com.
- Ropp, r.C. (2013). Skupina 17 (H, F, CL, BR, I) Alkalne zemeljske spojine. Fluoridski kalcij. V enciklopediji alkalnih zemeljskih spojin. Okrevano od Scientirect.com.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Valković, v. (2000). Meritve radioaktivnosti. V radioaktivnosti v okolju. Temeluminescentni detektorji (TLDS). Okrevano od Scientirect.com.
- « Nitruro de boro (BN) struktura, lastnosti, pridobivanje, uporabe
- Struktura silicijevega oksida (SiO2), lastnosti, uporabe, pridobivanje »

