Struktura silicijevega oksida (SiO2), lastnosti, uporabe, pridobivanje

- 2171
- 370
- Mr. Shane Larkin
On Silicijev oksid Gre za anorgansko trdno snov, ki jo tvori zveza silicijevega atoma in dveh kisika. Njegova kemična formula je sio2. Ta naravna spojina se imenuje tudi silicij ali silicijev dioksid.
Sio2 Je najpogostejši mineral v zemeljski skorji, saj je pesek sestavljen iz kremena. Glede na svojo strukturo je lahko silicijev dioksid kristalni ali amorfni. Je netopna v vodi, vendar se raztopi v alkaliji in v fluorhorični kislini HF.
 Pesek je vir silicijevega dioksida sio2. ರವಿಮುಂ [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons.
Pesek je vir silicijevega dioksida sio2. ರವಿಮುಂ [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons. Sio2 Prisoten je tudi v strukturi nekaterih rastlin, bakterij in gliv. Tudi v okostjih morskih organizmov. Poleg peska obstajajo tudi druge vrste kamnov, ki so kremen.
Silicijev dioksid ima zelo razširjeno uporabo, ki izpolnjuje različne funkcije. Najbolj razširjena uporaba je filtrirni material tekočin, kot so olja in oljni izdelki, pijača, kot so pivo in vino, ter sadni sokovi.
Ima pa še veliko drugih aplikacij. Eden najbolj uporabnih in najbolj pomembnih je v izdelavi bioaktivnega stekla, ki omogočajo "odri", kjer rastejo kostne celice, da proizvajajo manjkajoče kostne dele zaradi nesreče ali bolezni.
[TOC]
Struktura
Silicijev sio dioksid2 Gre za molekulo s tremi atom, v kateri je silicijev atom povezan z dvema atoma kisika s kovalentnimi vezmi.
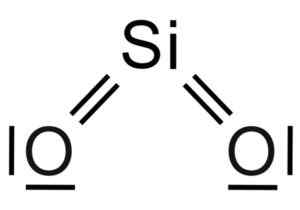 Kemična struktura molekule SIO2. Grasso Luigi [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons.
Kemična struktura molekule SIO2. Grasso Luigi [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons. Strukturna enota trdnega silicijevega dioksida je tetraeder, kjer silicijev atom obdaja 4 atomi kisika.
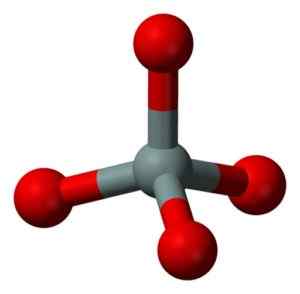 Strukturna enota trdnega kremena: siva = silicij, rdeča = kisik. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons.
Strukturna enota trdnega kremena: siva = silicij, rdeča = kisik. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons. Tetraedre se med seboj vežejo in si delijo kisikove atome svojih sosednjih vrhov.
Zato si silicijev atom deli na polovici vsakega od 4 atomov kisika in to pojasnjuje razmerje v spojini 1 silicijevega atoma pri 2 kisikovih atomih (SIO2).
 Tetrahedra delijo kisik v SIO2. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons.
Tetrahedra delijo kisik v SIO2. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons. SIO spojine2 Razdeljeni so v dve skupini: kristalni kremen in amorfni kremen.
Kristalne spojine kremena imajo strukture s ponavljajočimi se vzorci silicija in kisika.
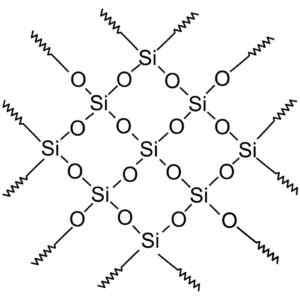 Kristalni kremen ima ponavljajoče se enote. Wersję rastrową Wykonał użytkownik Polskiego projektu wikipedii: Polyimerek, Zwektoryzował: Krzysztof Zajczkowski [gfdl (http: // www.GNU.Org/copyleft/fdl.html)]. Vir: Wikimedia Commons.
Kristalni kremen ima ponavljajoče se enote. Wersję rastrową Wykonał użytkownik Polskiego projektu wikipedii: Polyimerek, Zwektoryzował: Krzysztof Zajczkowski [gfdl (http: // www.GNU.Org/copyleft/fdl.html)]. Vir: Wikimedia Commons. Vsi silicijev kristal lahko štejemo za velikansko molekulo, kjer je kristalna mreža zelo močna. Tetraedre je mogoče povezati na različne načine, kar povzroča različne kristalne oblike.
Vam lahko služi: Bravais Networks: koncept, značilnosti, primeri, vajeV amorfnem silicijevem silicijevem silicijevem silicijem strukture so naključno povezane, ne da bi sledili rednemu vzorcu med molekulami in so v drugačnem prostorskem odnosu drug z drugim.
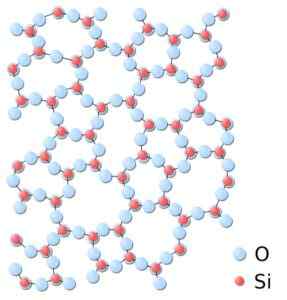 V amorfnem silicijevem silicijevem silicijem sindikati niso ponavljajoči ali enotni. Silicijev dioksid.SVG: *Silicijev.JPG: V: Uporabnik: jdrewitTerivevative Work: Matt [javna domena]. Vir: Wikimedia Commons.
V amorfnem silicijevem silicijevem silicijem sindikati niso ponavljajoči ali enotni. Silicijev dioksid.SVG: *Silicijev.JPG: V: Uporabnik: jdrewitTerivevative Work: Matt [javna domena]. Vir: Wikimedia Commons. Nomenklatura
-Silicijev oksid
-Silicijev dioksid
-Silicijev dioksid
-Kremen
-Tridimita
-Cristobalita
-Dioxosilano
Lastnosti
Fizično stanje
Barva brezbarvna do sive.
 Vzorec SIO2 Čisto. Lhchem [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
Vzorec SIO2 Čisto. Lhchem [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons. Molekularna teža
60.084 g/mol
Tališče
1713 ° C
Vrelišče
2230 ° C
Gostota
2,17-2,32 g/cm3
Topnost
Netopna v vodi. Amorfni silicijev dioksid je topen v alkaliji, še posebej, če je fino razdeljen. Topno v fluorhorhorhoric kislini HF.
Amorfni silicijev dioksid je manj hidrofilni, torej manj povezan z vodo kot kristalno.
Kemične lastnosti
Sio2 o Silicijev dioksid je v bistvu inerten pri večini snovi, zelo malo je reaktiven.
Se upira napadu klora2, BROMO BR2, Vodik h2 in večine kislin pri sobni temperaturi ali nekoliko višji. Napade fluor f2, HF fluorhorhorhoric kislina in alkaliji, kot so natrijev karbonat2Co3.
Sio2 Lahko ga kombiniramo s kovinskimi elementi in oksidi, da tvori silikate. Če se silicijev dioksik topi z alkalnimi kovinskimi karbonati pri približno 1300 ° C2.
Ni gorivo. Ima nizko toplotno prevodnost.
Prisotnost v naravi
Glavni vir kremena v naravi je pesek.
Sio2 o Silicijev dioksid je v obliki treh kristalnih sort: kremen (najbolj stabilen), Tridimita in Cristobalita. Amorphant za kremen so agata, jaspe in ónice. Opal je amorfni hidrirani kremen.
Obstaja tudi tako imenovani biogeni silicijev dioksid, torej tisti, ki ga ustvarjajo živi organizmi. Viri te vrste silicijevega dioksida so bakterije, glive, diatome, morske gobice in rastline.
Svetli in trdi deli bambusa in slame vsebujejo silicijev dioksid, okostja nekaterih morskih organizmov pa imajo tudi velik delež silicijevega dioksida; Vendar so najpomembnejši diatatonarji.
Diatomea dežele so geološki proizvodi propadajočih enoceličnih organizmov (alge).
Vam lahko služi: kozmični prahDruge vrste naravnega kremena
V naravi obstajajo tudi naslednje sorte:
- Sitreous silikani, ki so vulkansko steklo
- Milleritas, ki so naravno steklo, ki ga proizvaja zlitje silicijevega materiala pod vplivom meteoritov
- Staljeni silicijev dioksid, ki segreva kremen v tekočino in ohlajeno fazo, ne da bi omogočil kristalno
Pridobivanje
Silicijev dioksid iz arene dobimo neposredno iz kamnolomov.
 Arena kamnolom v Kaliforniji. Ruff Tux Cream Puff [CC0]. Vir: Wikimedia Commons.
Arena kamnolom v Kaliforniji. Ruff Tux Cream Puff [CC0]. Vir: Wikimedia Commons. Na ta način se pridobijo tudi diatomit ali diatomi, pri čemer uporabljajo podobne bagene in opreme.
Amorfni silicijev dioksid pripravimo na osnovi vodnih alkalnih kovinskih silikatnih raztopin (na primer natrijev NA) z nevtralizacijo s kislino, kot je žveplova kislina H2SW4, HCL klorovodikova kislina ali ogljikov dioksid2.
Če je končni pH raztopine nevtralen ali alkalen, dobimo oborini silicijev dioksid. Če je pH kislina, dobimo gel silicijev dioksid.
Pirogeni silicijev dioksid pripravimo z zgorevanjem hlapne silicijeve spojine, običajno silicijevega sicl tetraklorida4. Oborini silicijev dioksid dobimo iz vodne raztopine silikatov, do katere se doda kislina.
Koloidni kremen je stabilna disperzija amorfnih koloidnih delcev kremena v vodni raztopini.
Prijave
V več aplikacijah
Silicijev dioksid ali sio2 Ima najrazličnejše funkcije, na primer služi kot abrazivni, vpojni, antiapelmazante, polnjeni, motnjo in dajejo prednost odvzema drugih snovi, med številnimi drugimi načini zaposlitve.
Uporablja se na primer:
-V steklu, keramični, ognjevzdržni, abrazivni in topni proizvodnji stekla
-Razbarvanje in čiščenje olj in oljnih izdelkov
-V kalupih za livarno
-Kot antiapelmazante iz praškov vseh vrst
-Kot antispomant
-Za filtriranje tekočin, kot so topila za suho pranje, voda bazenov ter komunalna in industrijska odpadna voda
-Pri proizvodnji toplotnih izolatorjev, ognjenih opek in embalažnih materialov, odpornih na ogenj in kisline
-Kot izpolnjevanje izdelave papirjev in kartic, da bi bili bolj odporni
-Kot napolnjene s slikami za izboljšanje svojega pretoka in barve
-V materialih za poliranje kovin in les, saj jim dajo abrazivnost
-V kemijski analizi laboratoriji v kromatografiji in kot absorbent
-Kot antiapelmazante insekticidov in agrokemičnih formul, da bi pomagali mletje pesticidala in kot nosilec aktivne spojine
-Kot podpora za katalizator
-Kot polnjenje za okrepitev sintetične gume in gume
Vam lahko služi: vzdolžni valovi: značilnosti, razlike, primeri-Kot nosilec tekočine v živalski hrani
-V tiskanih črnilih
-Kot sušilni in adsorbent, v obliki silikagela
-Kot dodatek v cementu
-Kot pesek za hišne ljubljenčke
-V mikroelektronski izolatorji
-V termoptičnih stikalih
 Silicijev silika. Kenpei [cc by-sa 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]]. Vir: Wikimedia Commons.
Silicijev silika. Kenpei [cc by-sa 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]]. Vir: Wikimedia Commons. V živilski industriji
Amorfni silicijev dioksid je vključen v različne živilske izdelke kot večnamenska neposredna sestavina v različnih vrstah hrane. Ne smete presegati 2% končne hrane.
Na primer, služi kot antiapelmazante (da prepreči, da bi se določena živila držala) kot stabilizator pri proizvodnji piva kot antiprecipitatorja, za filtriranje vina, piva in sadnih sokov ali zelenjave.
 Ekipa za filtriranje vina z diatomi (SIO2). Fabio Ingroso [CC do 2.0 (https: // creativeCommons.Org/licence/by/2.0)]. Vir: Wikimedia Commons.
Ekipa za filtriranje vina z diatomi (SIO2). Fabio Ingroso [CC do 2.0 (https: // creativeCommons.Org/licence/by/2.0)]. Vir: Wikimedia Commons. Deluje kot tekoča absorbenta v nekaterih živilih in sestavinah mikrokapsul za aromatizirana olja.
Poleg tega sio2 Amorfno se uporablja s posebnim postopkom na površini plastike člankov za pakiranje hrane, ki deluje kot pregrada.
V farmacevtski industriji
Dodamo ga kot antiapelmazante sredstvo, zgoščevanje, gange in kot pomočnik, torej kot pomočnik za oblikovanje več zdravil in vitaminov.
V kozmetični industriji in osebni negi
Uporablja se v množici izdelkov: v obrazu v prahu, senčili za oči, oči za oči, šminke, barvanje, zaklonišča za ličila, talko, noge v prahu, barvila za lase in beljenje in belilo.
Tudi v oljih in kopalnih solnih, penastih kopelih, rokah in kremi za telo.
Tudi v nočnih kremah hidratacije, svetlosti in barvi za nohte.
V terapevtskih aplikacijah
Sio2 Prisoten je v bioaktivnem ali biovidriosnem steklu, katerega glavna značilnost je, da lahko kemično reagirajo z biološkim okoljem, ki jih obdaja, in tvorijo močno in trpežno povezavo z živim tkivom.
Ta vrsta materiala služi za izdelavo kostnih nadomestkov, kot so obraze, na primer "odri", v katerih bodo rasle kostne celice. Dokazali so dobro biokompatibilnost s kostmi in mehkimi tkivi.
Ti biovidriji bodo omogočili, da si opomorejo kosti od obraza do ljudi, ki so jih izgubili po naključju ali bolezni.
Tveganja
Zelo tanke delce silicijevega dioksida je mogoče suspendirati v zraku in tvoriti neekplazivne praške. Toda ta prah lahko draži kožo in oči. Njegovo vdihavanje povzroči draženje dihalnih trakta.
Poleg tega vdihavanje silicijevega prahu povzroči dolgoročno poškodbo pljuč, imenovano silikoza.
Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Silicijev dioksid. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Da Silva, m.R. et al. (2017). Tehnike zelene ekstrakcije. SORBNTS na osnovi kremena. Pri razumevanju analitične kemije. Okrevano od Scientirect.com.
- Ylänen, h. (urednik). (2018). Bioaktivna očala: materiali, lastnosti in aplikacije (druga izdaja). Elsevier. Okrevano iz knjig.Google.co.pojdi.
- Windholz, m. et al. (uredniki) (1983) Indeks Merck. Enciklopedija kemikalij, drog in bioloških snovi. Deseta izdaja. Merck & co., Inc.
- Mäkinen, J. In suni, t. (2015). Debeli filmi SOI rezine. V priročniku Materialov in tehnologij MEMS na osnovi silicija (druga izdaja). Okrevano od Scientirect.com.
- Sirto, l. et al. (2010). Termo-optična stikala. Silicijevi nanokristali. Okrevano od Scientirect.com.
- « Struktura kalcijevega fluorida (CAF2), lastnosti, uporabe
- 275 piropos za romantične in seksi moške »

