Značilnosti fenilalanina, funkcije, biosinteza, hrana
- 5083
- 1198
- Ricky Dach
The Fenilalanin (Phe, F) je ena od devetih esencialnih aminokislin, torej je človeško telo endogeno sintetizirano. V svoji stranski verigi ima ta aminokislina ne -polarna aromatična spojina, ki jo označuje.
Znanstveniki j so leta 1879 prvič ugotovili fenilalanin ali β-fenil-amino propionsko kislino. H. Schulze in m. Barbieri iz rastline iz družine Fabaceae, znane kot Lupinus luteus ali "rumeni altramuz".
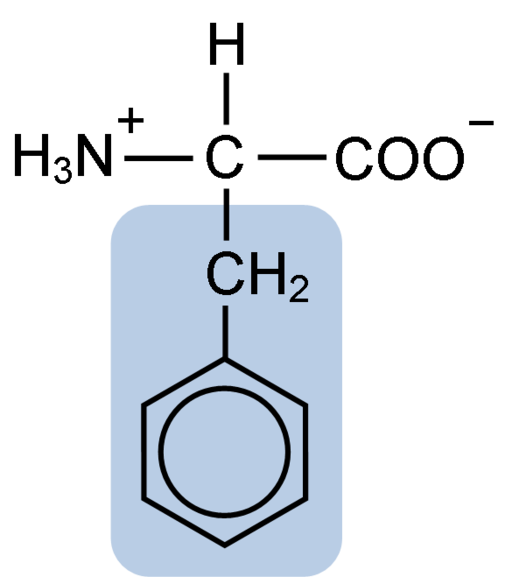
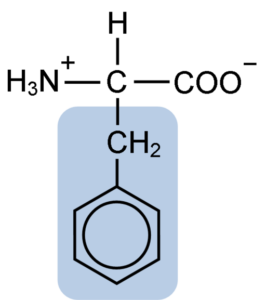 Kemična struktura aminokislinskega fenilalanina (vir: Klavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons)
Kemična struktura aminokislinskega fenilalanina (vir: Klavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons) Dipéptide L-fenilalanin-L-aspartil je znan kot aspartam ali "Nutrasweet", ki je sladilo, ki se sintetično in široko uporablja v restavracijah in kavarnah, običajno za sladkanje pijač, kot so kava, čaj, limonada in druge pijače.
V sadju z vročimi značilnostmi je pretvorba L-fenilalanina v fenolne estre, kot sta Eugenol in njegovi metilični derivati.
Glede na obliko ima lahko fenilalanin različne okuse. Na primer, oblika L-fenilalanin ima sladko aromo in okus, D-fenilalanin.
Ker ima močan hidrofobni značaj, je fenilalanin ena glavnih sestavin mnogih smol v naravi, kot je polistiren. Te smole, ko pridejo v stik z molekulami vode, tvorijo zaščitno ali pokrito strukturo, znano kot "Clatrato".
Gene, ki kodirajo za biosintezo pot fenilalanin.
[TOC]
Značilnosti in struktura
Fenilalanin deli z vsemi aminokislinami karboksilna skupina (-HOH), amino skupino (-NH2) in atom vodika (-H), ki so pritrjeni na centralni atom ogljika, znan kot ogljik α. Poleg tega ima seveda stransko verigo ali značilno skupino R.
Fenilalanin je ena od treh aminokislin, ki imajo aromatične ali benzenske obroče kot substituente v stranskih verigah. Te spojine niso polarne in so zato zelo hidrofobne.
Zadevna aminokislina je še posebej hidrofobna, saj za razliko od tirozina in triptofana (druga dve aminokislini z aromatičnimi obroči) nimajo amino ali hidroksilnih skupin, združenih s svojim benzenskim obročem.
Aromatična, benzoična ali sadillanin skupina fenilalanina ima značilno benzensko strukturo: ciklični obroč je strukturiran s 6 ogljikovimi atomi, ki imajo med njimi resonanco zaradi prisotnosti treh dvojnih vezi in treh preprostih vezi v notranjosti.
Za razliko od tirozina in triptofana, ki lahko pridobi pozitivno in negativno obremenitev, fenilalanin ohrani svojo nevtralno obremenitev, saj benzenski obroč ni ioniziran, obremenitve karboksilnih in amino skupin.
Klasifikacija
Aminokisline so razvrščene v različne skupine glede na značilnosti, ki jih imajo njihove stranske verige ali R skupine, saj se lahko razlikujejo po velikosti, strukturi, funkcionalnih skupinah in celo v električnem naboju.
Kot rečeno, je fenilalanin razvrščen v skupino aromatičnih aminokislin, skupaj s tirozinom in triptofanom. Vse te spojine imajo aromatične obroče v svoji strukturi, vendar imata tirozin in triptofan ionizabilne skupine v substituentih svojih R skupinah.
Vam lahko služi: alopatrična specifikacija: koncept, proces in primeriZnačilnosti absorpcije beljakovin pri valovni dolžini 280 nm so posledica prisotnosti aminokislin, razvrščenih v skupino fenilalanina, saj zlahka absorbirajo ultravijolično svetlobo skozi svoje aromatične obroče.
Vendar se je pokazalo, da fenilalanin absorbira v veliko manjšem deležu kot tirozin in triptofan, zato je pri analizi nekaterih beljakovin njegova absorbanca predvidljiva.
Stereokemija
Vse aminokisline imajo osrednji quiralni ogljik, ki ima štiri združene atome ali skupine in, kot že rečeno, je ta atom identificiran kot ogljik α. Na podlagi tega ogljika lahko najdemo vsaj dva stereozomera vsake aminokisline.
Stereoizomeri so molekule s spekularnimi slikami, ki imajo enako molekularno formulo, vendar se med seboj ne prekrivajo, kot so na primer roke in noge. Spojine, ki eksperimentalno zavrtijo desno polarizirano svetlobno ravnino, so označene s črko D, in tiste, ki to počnejo na levi.
Pomembno je komentirati, da je razlikovanje med d-fenilalaninom in L-fenilalaninom ključnega pomena za razumevanje presnove te aminokisline v telesu vretenčarjev.
Oblika l-fenilalanin se presnavlja in izkorišča za konstrukcijo celičnih beljakovin, medtem ko je bil D-fenilalanin v krvnem obtoku kot zaščitno sredstvo proti reaktivnim kisikovim vrstam (ROS).
Funkcije
V 90. letih se je mislilo, da je fenilalanin le pri nekaterih rastlinskih vrstah. Vendar je danes znano, da je prisoten v skoraj vseh hidrofobnih področjih beljakovin, pravzaprav je fenilalanin glavni sestavni del aromatičnih kemičnih vrst beljakovin.
V rastlinah je fenilalanin bistvena sestavina vseh beljakovin; Poleg tega je eden od predhodnikov sekundarnih presnovkov, kot so fenilpropanoidi (ki so del pigmentov) obrambnih molekul, flavonoidov, biopolimerov, kot sta lignin in suberin.
Fenilalanin je osnovna struktura, ki tvori številne molekule, ki vzdržujejo nevronsko homeostazo, med katerimi so peptidi, kot so vazopresin, melanotropin in encefalin. Poleg tega je ta aminokislina neposredno vključena v sintezo adrenokortopskega hormona (ACTH).
Tako kot večina beljakovinskih aminokislin je tudi fenilalanin del skupine ketogenih in glukogenih aminokislin, saj zagotavlja ogljikovo okostje posrednikov Krebs.
Ko je v presežku, se fenilalanin pretvori v tirozin in nato v fumarat, posrednik Krebsovega cikla.
Biosinteza
Fenilalanin je ena redkih aminokislin, ki jih večina vretenčarskih organizmov ne more sintetizirati. Trenutno so za to aminokislino v prokariotskih organizmih, v kvasovkah, v rastlinah in pri nekaterih vrstah gliv znane samo biosintetske poti.
Geni, odgovorni za sintezno pot, so zelo ohranjeni med rastlinami in mikroorganizmi, zato ima biosinteza podobne korake pri skoraj vseh vrstah. Tudi nekateri encimi na poti so prisotni pri nekaterih živalih, vendar jih ne morejo sintetizirati.
Biosinteza fenilalanina v rastlinah
Pri rastlinskih vrstah se fenilalanin sintetizira po notranji presnovni poti v kloroplastih, znanih kot "vnaprejšnja pot". Ta pot je presnovno povezana z "Shikimato pot", skozi L-Arogenato, enim od presnovkov, ki so nastali med slednjim.
Vam lahko služi: topoisomeraza: kaj so, značilnosti, funkcije, vrsteEncim inhydratasa Arewood katalizira reakcijo v tri korake, v kateri pretvori aromatični obroč arogenata v značilen benzenski obroč fenilalanina.
Ta encim katalizira transaminacijo, dehidracijo in dekarn.
Predhodnoat poleg nakopičenega fenilpiruvata v notranjosti (svetlobe) kloroplasta se lahko pretvori v fenilalanin z reakcijo, ki jo katalizira encim aminotransferaza propenato, ki se amino skupino prenaša na arogatacijo dehidrataze in ga prepoznamo tako, da ga prepoznamo tako, da ga prepoznamo tako arogatat dehidrataza in ga prepoznamo tako, da ga prepoznamo tako arogenata dehidrataza do sinteze fenilalanina.
V nekaterih vrstah Pseudomonas Nadomestne poti so bile opisane na profenato, ki uporabljajo različne encime, katerih substrati za sintezo fenilalanina so tudi vnaprej in arogenat.
Degradacija
Fenilalanin lahko presnavljamo na več načinov iz hrane. Vendar se največja količina študij osredotoča na svoj cilj na celicah centralnega živčnega tkiva in ledvičnih tkiv.
Jetra so glavni organ za razgradnjo ali katabolizem fenilalanina. V hepatocitih je encim, znan kot hidroksilaza fenilalanin, ki lahko pretvori fenilalanin v tirozin ali v spojini L-3,4-dihidroksifenilalanin (L-DOPA).
Spojina L-DOPA je predhodnik norepinefrina, epinefrina in drugih hormonov ter peptidov z aktivnostjo v živčnem sistemu.
Fenilalanin lahko oksidiramo v možganskih celicah s pomočjo hidroksilaze tirozin encima, ki je odgovoren za kataliziranje pretvorbe fenilalanina v dopakrom v prisotnosti L-askorbinske kisline.
Prej se je mislilo, da samo tirosin hidroksilazo tirozin hidrosin, vendar je bilo ugotovljeno, da ta fenilalanin in tirozin hidroksil v istem deležu in da hidroksilacija fenilanina zavira hidroksilacijo tirozina.
Trenutno je znano, da visoki deleži tirozina zavirajo encimsko aktivnost hidroksilaze tirozina, vendar isto ne velja za fenilalanin.
Živila, bogata s fenilalaninom
Vsa hrana, bogata z beljakovinami, imajo vsebnost fenilalanina med 400 in 700 mg za del zaužite. Živila, kot so trdno olje, sveža tuna, jastogi, ostrige in druge školjke, vsebujejo več kot 1.000 mg na del zaužite hrane.
Goveje in prašičje meso imata tudi visoko raven fenilalanina. Vendar niso tako visoke kot koncentracije pri morskih živalih. Na primer, izdelki za slanino, govedino, jetra, piščanca in mleka imajo med 700 in 900 mg fenilalanina zaradi obroke hrane.
Oreščki, kot so arašidi in oreščki različnih vrst, so druga živila, ki imajo dobro količino fenilalanina. Zrna, kot so soja, čičerika in druge stročnice, lahko po delu zagotovijo med 500 in 700 mg fenilalanina.
Kot nadomestni vir lahko fenilalanin presnavljamo iz aspartama.
Prednosti vašega vnosa
Fenilalanin najdemo v vseh beljakovinah, ki jih uživamo. Najmanjša dnevna poraba za odrasle in povprečna velikost je približno 1000 mg, potrebna za sintezo beljakovin, hormone, kot so dopamin, različni nevrotransmiterji itd.
Lahko vam služi: kakšna je naravna raznolikost zemlje?Poraba te presežne aminokisline je predpisana za ljudi, ki imajo depresivne motnje, bolečine v sklepih in kožne bolezni, saj njegova poraba poveča sintezo beljakovin in oddaja biomolekul, kot so epinefrin, norepinefrin in dopamin.
Nekatere študije kažejo, da porabljeni fenilalanin ne povzroča bistvenih izboljšav pri nobeni od teh motenj, vendar lahko njihova pretvorba v tirozin, ki se uporablja tudi za sintezo signalnih molekul živčni sistem.
Zdravila, oblikovana proti zaprtju. Na splošno ta zdravila vsebujejo mešanice teh treh aminokislin v svojih oblikah-.
Motnje pomanjkanja
Ravni fenilalanina v krvi so pomembne za ohranjanje pravilnega delovanja možganov, saj so fenilalanin, tirozin in triptofan substrati za sestavljanje različnih nevrotransmiterjev.
Nekatere motnje se bolj povezujejo s primanjkljajem v presnovi te aminokisline, kar ustvarja presežek, namesto pomanjkanja.
Fenilcetonurija, nenavadna dedna bolezen pri ženskah, prizadene jetrno hidroksilacijo fenilalanina in naredi plazemsko raven te aminokisline pretirane, tako da povzroči nevronsko apoptozo in vpliva na normalen razvoj možganov.
Če ženska s fenilcetonurijo zanosi, lahko plod predstavlja tisto, kar je znano kot "hiperfenilalaninemijo materinski" fetalni sindrom ".
To je zato, ker ima plod visoke koncentracije fenilalanina v krvi (skoraj podvoji standarde), katerega izvor je povezan z odsotnostjo jetrne hidroksilaze fenilalanina ploda, ki se ne razvija do 26 tednov gestacije.
Fetalni sindrom s hiperfenilalaninemijo mater, proizvaja fetalno mikrocefalijo, ponavljajoča se splavi, srčne bolezni in celo ledvične malformacije.
Reference
- Biondi, r., Brancorsini, s., Poli, g., Egidi, m. G., Capodicasa, npr., Bottiglieri, l.,… & Micu, r. (2018). Zaznavanje in čiščenje hidroksilnega radikala z D-fenilalanin hidroksilacijo v človeških tekočinah. Talanta, 181, 172-181
- Cho, m. H., Koreja, o. R., Yang, h., Bedgar, d. L., Laskar, d. D., Anterola, a. M.,… & Kang, c. (2007). Fenilalanin biosinteza v Thalian Arabidopsis Identifikacija in karakterizacija argenatskih dehidrata. Časopis za biološko kemijo, 282 (42), 30827-30835.
- Fernstrom, J. D., & Fernstrom, m. H. (2007). Tirozin, fenilalanin in sinteza in delovanje katoholamina v možganih. The Journal of Nutrition, 137 (6), 1539S-1547S.
- Hou, j., Vázquez-González, m., Fadeev, m., Liu, x., Lavi, r., & Willner, jaz. (2018). Katalizirana in elektrokatalizirana oksidacija L-tirozina in L-fenilalanina do dopakroma z nanocimi. Nano Letters, 18 (6), 4015-4022.
- Nelson, d. L., Lehninger, a. L., & Cox, m. M. (2008). Lehningerjeva načela biokemije. Macmillan.
- Perkins, r., & Vaida, v. (2017). Fenilalanin poveča prepustnost membrane. Journal of American Chemical Society, 139 (41), 14388-14391.
- Plimmer, r. H. Do. (1912). Kemična ustava beljakovin (vol. 1). Longmans, zelena.
- Tensley, g. (2018). Zdravstvena linija. Pridobljeno 5. septembra 2018 z www.Zdravstvena linija.com/prehrana/fenilalanin
- Tohge, t., Watanabe, m., Hoefgen, r., & Fernie, do. R. (2013). Biosinteza Shikimate in fenilalanin v zeleni rodovi. Meje v rastlinskih znanosti, 4, 62.

