Značilnosti izolevcina, funkcije, biosinteza, hrana
- 2874
- 354
- Miguel Gutmann DVM
The izolecin (Ile, i) je ena od 22 aminokislin v naravi kot del beljakovin. Glede na dejstvo, da človeško telo, tako kot pri nekaterih drugih sesalcih.
To aminokislino je prvič leta 1903 prvič izoliral znanstvenik F. Ehrlich iz dušikovih sestavin pese ali melase pese. Nato je isti avtor ločil izolevcin od produktov razgradnje fibrina in drugih beljakovin.
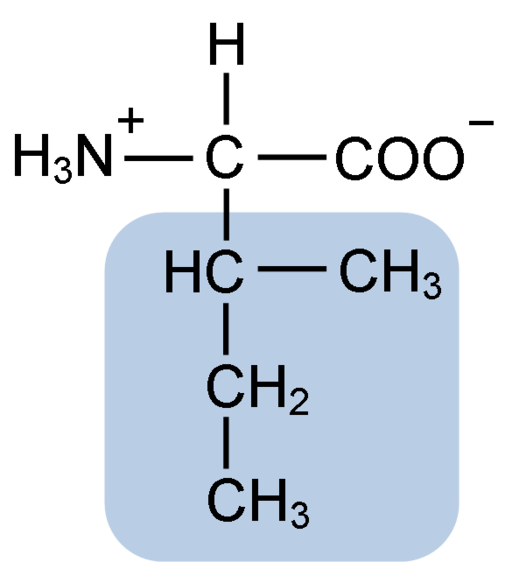
 Kemična struktura izolevcinske aminokisline (vir: Klavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons)
Kemična struktura izolevcinske aminokisline (vir: Klavecin [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)] prek Wikimedia Commons) Gre za ne -polarne aminokisline, ki je prisotna v večini celičnih beljakovin živih organizmov, poleg tega pa je del aminokislin z razvejanimi verigami BCAA (iz angleščine BRanched CHain DoMoja ne DoCids), Skupaj z Leucino in Valino.
Ima funkcije pri vzpostavljanju terciarne strukture številnih beljakovin, poleg tega pa sodeluje pri oblikovanju različnih presnovnih prekurzorjev, povezanih s presnovo celične energije.
[TOC]
Značilnosti
Isoleucin je razvrščen v skupino ne -polarne aminokisline s skupinami ali verigami aifatske narave, to je z ogljikovodičnimi ogljikovodičnimi verigami.
Zaradi te značilnosti aminokisline te skupine, kot so Alanin, Valina in Leucina.
Ta ne -polarna aminokislina tehta približno 131 g/mol in je v beljakovinah prisotna v deležu, ki je blizu 6%, pogosto "zakopana" v središču (zahvaljujoč hidrofobnim lastnostim).
Struktura
Isoleucin je α-aminokislina, ki ima, tako kot druge aminokisline, osrednji ogljikov atom, imenovan α (ki je kiralno), na katerega so združene štiri različne skupine: atom vodika, amino skupina (-NH2), a karboksilna skupina (-HOH) in stranska veriga ali r grupo.
Isolevcinska skupina R je sestavljena iz preprostega razvejanega ogljikovodika 4 ogljikovih atomov (-ch3-ch2-ch (ch3)), v čigar veriga.
Zaradi te značilnosti ima izolevcin štiri možne načine: dva sta optična izomeri, znani kot L-izolevcin in D-izolevcin, druga dva pa diastereoizomera L-izolevcina. Prevladujoča oblika v beljakovinah je L-izolecin.
Molekularna formula izolevcina je C6H13NO2, njegovo kemijsko ime.
Funkcije
Isoleucin ima več fizioloških funkcij pri živalih, vključno z
- Celjenje ran
- Razstrupljanje dušikovih odpadkov
- Stimulacija imunskih funkcij in
- Spodbujanje izločanja različnih hormonov.
Šteje se za glikogeno aminokislino, saj služi kot predhodna molekula za sintezo posrednikov cikla citrusov kisline (KREBS cikel), ki pozneje prispevajo k nastajanju glukoze v jetrih.
Zaradi tega velja, da izolevcin sodeluje pri uravnavanju ravni glukoze v plazmi, kar ima pomembne posledice z vidika telesne energije.
Isoleucin prispeva k sintezni poti glutamina in alanina, ki deluje v prid ravnotežju med razvejanimi verižnimi aminokislinami.
Na kliničnem področju nekateri avtorji poudarjajo, da so lahko povečanje koncentracij izolevcina, levcina, tirozina in valina značilni markerji celic, ki jih prizadene tumor, čemur sledi povečanje ravni glutamina.
Druge funkcije
Različne znanstvene raziskave so pokazale, da je izolevcin potreben za sintezo hemoglobina, beljakovin, ki je odgovoren za prevoz kisika v krvi mnogih živali.
Poleg tega ta aminokislina aktivira vnos hranil v celice; Nekatere študije razkrivajo, da lahko med daljšim postjo nadomesti glukozo kot vir energije, poleg tega pa je ketogena aminokislina.
Lahko vam služi: časovna premica biologijeKetogene aminokisline so tiste, katerih ogljikove okostja je mogoče shraniti, kot so maščobne kisline ali ogljikovi hidrati, zato delujejo v rezervi za energijo.
Aminokisline izolevcina in drugih razvejanih verig (poleg rastnih faktorjev in okoljskih razmer) delujejo na aktiviranju belega ali ciljnega signalnega poti rapamicina, mTOR (iz angleščine mTananistična TArget tudiF RApamicin).
Ta pot je pomembna signalna pot v evkariotih, ki lahko nadzorujejo rast in presnovo celic, pa tudi sinteza beljakovin in avtofagijskih dogodkov. Poleg tega nadzoruje napredek staranja in nekatere patologije, kot sta rak ali diabetes.
Biosinteza
Ljudje in druge živali ne morejo sintetizirati izolevcina, vendar je to del celičnih beljakovin zahvaljujoč njihovi pridobitvi hrane, ki jo vsak dan uživamo.
Rastline, glive in večina mikroorganizmov lahko sintetizirajo to aminokislino iz nekoliko zapletenih poti, ki so običajno medsebojno povezane s tistimi iz drugih aminokislin.
Obstajajo na primer načini za proizvodnjo izolevcina, lizina, metionina in treonina iz aspartata.
V bakterijah, natančneje, se izolevcin nastaja iz aminokisline s treoninom, skozi piruvat, skozi pot, ki pomeni kondenzacijo 2 piruvatskih karbonov z molekulo α-ektobutirata, ki izhaja iz treonina.
Reakcija se začne z delovanjem encima dehidrataze, ki katalizira dehidracijo treonina za proizvodnjo α-ecotobutirata in amonija (NH3). Nato k korakom prispevajo isti encimi, ki sodelujejo pri biosintezi valine
- Transaminacija
- Oksidativna dekarboksilacija ustreznih ketocidov in
- Dehidrogenacija.
Pri tej vrsti mikroorganizmov je sinteza aminokislin, kot so lizin, metionin, treonin in izolevcin.
Čeprav sta izolevcin, kot levcin in valin, bistvene aminokisline za človeka, lahko aminotransferae encimi, prisotni v telesnih tkivih.
Degradacija
Kot velik del aminokislin, ki jih poznamo v naravi, se lahko izolevcin razgradi, da tvori posrednike različnih presnovnih poti, med katerimi Krebsovi cikel (ki zagotavlja največjo količino koencimov, ki delujejo za proizvodnjo energije ali za biosintezo drugih spojin ).
Tako izolevcin kot triptofan, lizin, fenilalanin, tirozin, treonin in levcin lahko uporabimo za proizvodnjo acetil-CoA, ključnega presnovnega posrednika za več celičnih reakcij.
Za razliko od drugih aminokislin se v jetrih ne razgradijo razvejane verižne aminokisline (levcin, izolevcin in valin), ampak so oksidirane kot goriva v mišicah, možganih, ledvicah in maščobnem tkivu.
Ti organi in tkiva lahko te aminokisline uporabljajo zahvaljujoč prisotnosti encima aminotransferaze, ki lahko deluje na tri in ustvari ustrezno aminokislino α-ZO.
Ko se ti oksidirani aminokislini derivati proizvajajo, encimski kompleks α-Zo-ketoacid katalizira oksidativno dekarboksilacijo le-teh, kjer sprošča molekulo ogljikovega dioksida (CO2) in proizvaja derivati Acil-CoA v vprašanju.
Patologije, povezane s presnovo izolevcina
Napake v presnovi izolevcina in drugih aminokislin lahko povzročijo raznolikost čudnih in zapletenih patologij, kot je bolezen ""Urin javorjev sirup"(Urin z arce sirupom) ali razvejana veriga ketoacidurija.
Kot že ime pove, je za to bolezen značilna značilna aroma urina bolnikov, ki trpijo zaradi nje, poleg bruhanja, napadov, duševne zaostalosti in prezgodnje smrti.
Zlasti mora storiti z napakami v encimskem kompleksu α-cetocidne dehidrogenaze, tako da se v urin izločajo razvejane verižne aminokisline, kot sta izolevcin in njegovi oksidirani derivati.
Vam lahko služi: tafonomija: zgodovina, ohranjanje in spreminjanje fosilovSkupaj so patologije, povezane s katabolizmom razvejanih verižnih aminokislin, kot je izolevcin, znane kot organske kisline, čeprav so tiste, ki so neposredno povezane s to aminokislino.
Živila, bogata z izolecinom
Ta aminokislina je obilna v mišičnih tkivih živali, tako da meso živalskega izvora, kot so krava, svinjina, ribe in drugi podobni.
Najdemo ga tudi v mlekarni in njegovih derivatih, kot je sir. Je v jajcih in tudi v različnih vrstah semen in oreščkov, kot bistveni del beljakovin, ki jih predstavljajo.
V soji in grahu je obilna, pa tudi v ekstraktih kvasovk, ki se uporabljajo z različnimi prehranskimi nameni.
Ravni plazme izolevcina za odraslega človeka so med 30 in 108 μmol/L, za otroke in mlade med dvema in 18 leti so med 22 in 107 μmol/L in za dojenčke med 0 in 2 leti med 26 in 86 μmol/l.
Ti podatki kažejo, da je poraba bogatih živil v tej in drugih povezanih aminokislinah potrebna za vzdrževanje številnih fizioloških funkcij organizma, saj ga ljudje ne morejo sintetizirati od Nove.
Prednosti vašega vnosa
Prehranska dopolnila z izolevcinom običajno vsebujejo druge esencialne aminokisline razvejane verige, kot so valina ali levcin ali drugi.
Med najpogostejšimi primeri porabe izolevcina so prehranski dodatki, ki jih športniki uporabljajo za povečanje odstotka mišične mase ali sinteze beljakovin. Vendar pa se nenehno razpravlja o znanstveni podlagi, na kateri se podpirajo te prakse, in njihovi rezultati niso v celoti zagotovljeni.
Isolevcin pa se uporablja za preprečevanje presnovnih učinkov pomanjkanja vitamina (PELAGRA), značilnih za bolnike, ki imajo bogato dieto s sirkom in koruzo, ki so živila z visoko vsebnostjo levcina, kar lahko vpliva na presnovo triptofana in nikotinske kisline pri ljudeh.
Učinki pelagra na eksperimentalne podgane na primer vključujejo zamude rasti, ki jih premagajo z dodatkom izolevcina.
- V industriji proizvodnje živali
Na področju proizvodnje živali so bile pri pilotnih testih za hranjenje prašičev v nadzorovanih pogojih uporabljene aminokisline, kot so lizin, treonin, metionin in izolevcin.
Zdi se, da izolevcin vpliva na asimilacijo dušika, čeprav ne prispeva k povečanju teže teh domačih živali.
- V nekaterih kliničnih pogojih
Nekatere publikacije kažejo, da je izolevcin sposoben znižati raven glukoze v plazmi, zato je njihov vnos priporočljiv pri bolnikih, ki trpijo zaradi motenj, kot so diabetes ali nizka stopnja proizvodnje insulina.
Virusne okužbe
Dopolnjevanje izooleucina se je izkazalo za koristno pri bolnikih, okuženih z rotavirusom, ki povzročajo bolezni, kot sta gastroenteritis in driska pri majhnih otrocih in drugih mladih živalih.
Nedavne študije kažejo, da poraba te aminokisline s pomočjo eksperimentalnih živali z zgoraj omenjenimi značilnostmi (okužena z rotavirusom) pomaga pri rasti in uspešnosti prirojenega imunskega sistema zahvaljujoč aktiviranju signalnih poti ali receptorjev s prepoznavanjem prepoznavanja prepoznavanja Vzorci.
Motnje pomanjkanja
Isolevcin pomanjkljivosti lahko ima težave pri vidu, koži (kot je dermatitis) in črevesju (očitno kot driska in druge manifestacije prebavil))).
Glede na dejstvo, da je bistvena aminokislina za tvorbo in sintezo hemoglobina, pa tudi za regeneracijo eritrocitov (krvnih celic), lahko imajo hude pomanjkljivosti v izolevcinu resne fiziološke posledice, zlasti povezane z anemiji in drugimi hematološkimi bolezni.
Vam lahko služi: terciarni potrošnikiTo je bilo eksperimentalno dokazano pri "normalnih" glodalcih, na katere so bile v tem izolevcinu zagotovljene slabe diete, kar se konča z razvojem pomembnih anemičnih slik.
Vendar izolevcin sodeluje pri nastajanju hemoglobina le pri dojenčkih, saj protein odraslega človeka nima pomembnih količin take aminokisline; To pomeni, da je pomanjkanje izolevcina bolj očitno v prvih fazah razvoja.
Reference
- Aders Plimmer, r. (1908). Kemična ustava beljakovin. odšel sem. London, Velika Britanija: Longmans, Green in Co.
- Aders Plimmer, r. (1908). Kemična ustava beljakovin. II. Del. London, Velika Britanija: Longmans, Green in Co.
- Barret, g., & Elmore, D. (2004). Aminokisline in peptidi. Cambridge: Cambridge University Press.
- Blau, n., Duran, m., Blaskovics, m., & Gibson, k. (devetnajst devetdeset šest). Zdravnikov vodnik po laboratorijski diagnozi presnovnih bolezni (2. izd.).
- Bradford, h. (1931). Zgodovina odkritja aminokislin. Ii. Pregled aminokislin, opisanih od leta 1931, kot sestavine izvornih beljakovin. Napredek v kemiji beljakovin, 81-171.
- Campos-Ferraz, str. L., Bozza, t., Nicastro, h., & Boat, do. H. (2013). Različni učinki levcina ali mešanice amininokisline z razvejano verigo (levcin, izolevcin in valina) na odpornost proti utrujenosti ter razgradnjo mišic in jetrnih glikogena pri usposobljenih podganah podgan podgan. Prehrana, 29(11-12), 1388-1394.
- Champe, str., & Harvey, r. (2003). Aminokisline aminokisline. V Ilustrirane ocene Lippincotta: Biokemija (3. izd., pp. 1-12). Lippincott.
- Chandran, k., & Damodaran, m. (1951). Amino-kisline in beljakovine v tvorbi hemoglobina 2. Izolecin. Journal Biochemical, 49, 393-398.
- Chung, a. S., & Beames, r. M. (1974). Lizin, treonin, metionin in izolevcinski dopolnjevanje ječmena za mir za gojenje prašičev. Pes. J. Odmik. Sci., 436, 429-436.
- Dejong, c., Meijerink, w., Van berlo, c., Deutz, n., & Soeters, str. (devetnajst devetdeset šest). Descosed plazemski izolevcin koncent po zgornjem prebavilih pri ljudeh. Črevesje, 39, 13-17.
- Edsall, J. (1960). Amininokisline, beljakovine in biokemija raka (Vol. 241). London: Academic Press, Inc.
- Britannica Encyclopeedia. (2012). Pridobljeno 30. avgusta 2019 iz https: // www.Britannica.com/znanost/izolecin
- Gelfand, r., Hendler, r., & Sherwin, r. (1979). Prehranski ogljikovi hidrat in presnova zaužitja beljakovin. Lancet, 65-68.
- Hudson, b. (1992). Biokemija prehranskih beljakovin. Springer-Science+Business Media, B.V.
- Knerr, i., Vockley, J., & Gibson, k. M. (2014). Motnje levcina, izolevcina in presnove valina. V n. Blau (ed.), Zdravnikov vodnik za diagnozo, zdravljenje in spremljanje podedovanih presnovnih bolezni (str. 103-141).
- Korman, s. H. (2006). Zaročene napake degradacije izolevcina: pregled. Molekularna genetika in presnova, 89(4), 289–299.
- Krishnaswamy, k., & Gpalan, c. (1971). Vpliv izolevcina na kožo in elektroencefalogram v pellagra. Lancet, 1167-1169.
- Martin, r. In., & Kirk, k. (2007). Transport esencialnega hranljivega izolevcina v človeških eritrocitih, okuženih z malarijo parazit plazmodium falciparum. Kri, 109(5), 2217-2224.
- Nacionalni center za informacije o biotehnologiji. Baza podatkov Pubchem. L-izolevcin, cid = 6306, https: // pubchem.NCBI.NLM.ameriški nacionalni inštitut za zdravje.GOV/COMPUND/L-ISOLEUCIN (dostopano na avgustu. 31, 2019)
- Nuttall, f. Q., Schweim, k., & Gannon, m. C. (2008). Vpliv oralno danega izolevcina z in brez glukoze na koncentracije insulina, glukagona in glukoze pri nediabetičnih osebah. Evropski e-novinar klinične prehrane in presnove, 3(4), 152-158.
- Van berlo, c. L. H., Van de bogaard, do. In. J. M., Van der Heijden, m. Do. H., Van eijk, h. M. H., Janssen, m. Do., Bost, m. C. F., & Soeters, str. B. (1989). Je neverjetna osvoboditev amoniaka po krvavitvi v prebavnem traktu, priznanje popolne odsotnosti izolevcina v hemoglobinu? Študija pri prašičih. Hepatologija, 10(3), 315–323.
- Vickery, h. B., & Schmidt, c. L. Do. (1931). Zgodovina odkritja aminokislin. Kemični pregledi, 9(2), 169–318.
- Wolfe, r. R. (2017). Amini z razvejano verigo in sintezo mišičnih beljakovin pri ljudeh: mit ali resničnost? Časopis Mednarodnega društva za športno prehrano, 14(1), 1-7.
- Wu, g. (2009). Amininokisline: presnova, funkcije in prehrana. Amininokisline, 37(1), 1-17.
- « Zgodovina industrijske ekologije, cilji, primeri
- Značilnosti fenilalanina, funkcije, biosinteza, hrana »

