Pojasnilo kemičnega ravnovesja, dejavniki, vrste, primeri

- 3063
- 957
- Raymond Moen
On Kemično ravnovesje To je stanje, ki doseže reverzibilne kemijske reakcije, pri katerih se ne izdelujejo spreminjanja koncentracij ali reagentov, niti vpletenih izdelkov se ne proizvajajo. Zanj je značilno, da je dinamičen in ni statičen; to pomeni, da molekule ali atomi še naprej reagirajo, vendar ohranjajo iste koncentracije v času.
Podobno ravnovesje je predstavljeno tudi v faznih spremembah, čeprav ni prekinitev povezav. Na primer, tekočina je lahko v ravnovesju s svojimi hlapi, pa tudi s trdno snovjo. Prav tako trdna snov vzpostavi ravnovesje z vodami, ki ga obdajajo, ko se obori ali kristalizira.
 V kemični industriji je znanje kemijskega ravnovesja bistvenega pomena za pridobitev sinteze z boljšimi donosi. Vir: pxhere.
V kemični industriji je znanje kemijskega ravnovesja bistvenega pomena za pridobitev sinteze z boljšimi donosi. Vir: pxhere. Ko je kemično ravnovesje vzpostavljen, ni mogoče pridobiti več sprememb ali odzivov, razen če nanjo prekinejo ali vplivajo zunanja dejanja. Tako je v sintezi izdelka več parametrov, kot so tlak, prostornina ali temperatura.
V nasprotnem primeru bodo znesek izdelkov nezadovoljive; to pomeni, da bo prišlo do slabe reakcijske zmogljivosti. Zato je kemično ravnovesje ključnega pomena za kemično industrijo in na splošno za vsako sintezo, ne glede na njegovo lestvico.
V kemičnem ravnovesju je lahko več izdelkov ali več reagentov. Vse je odvisno od tega, kje se ravnotežje razselje. Ob upoštevanju več dejavnikov lahko premaknete ravnovesje proti kateri koli od dveh smeri dvojne puščice v reverzibilni reakciji.
[TOC]
Pojasnilo kemičnega ravnovesja
Pred ravnotežjem
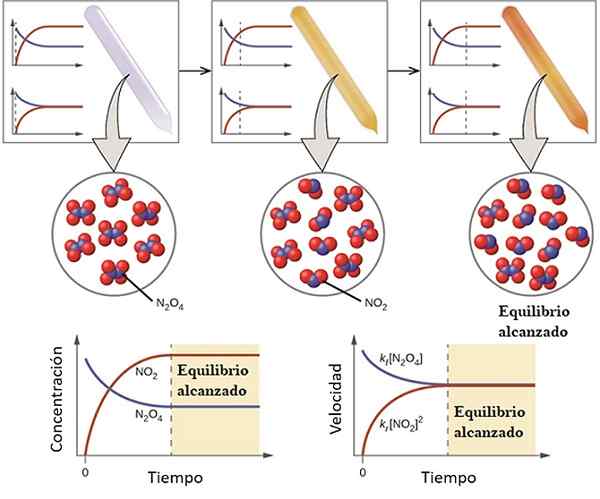 Primer, kako se reakcija približuje njenemu ravnotežju. Vir: OpenStax/cc by (https: // createCommons.Org/licence/by/4.0
Primer, kako se reakcija približuje njenemu ravnotežju. Vir: OpenStax/cc by (https: // createCommons.Org/licence/by/4.0 Da bi razumeli, kaj kemično ravnovesje upošteva naslednjo reverzibilno reakcijo:
N2Tudi4(g) ⇌ št2(g)
Plin n2Tudi4 Je brezbarven, medtem ko plin ne2 predstavlja rjavo ali rjavo obarvanost. Če se določena količina N vbrizga v majhno vialo ali posodo2Tudi4, To bo brezbarvno, dokler ne bo ravnotežje.
Na levi strani zgornje slike je razvidno, da so skoraj vse molekule N2Tudi4 in da koncentracija št2 Je nič.
Prikažite tudi dva grafa, ki predstavljata, kakšen je trend v tehtnici, s pikčasto črto, ki kažejo položaj v času, ko se vbrizga samo N2Tudi4. Graf ustreza koncentraciji vs. Čas (navzdol), drugi pa ustreza grafu pri Speed Vs. Čas (navzdol desno).
Koncentracija n2Tudi4, [N2Tudi4] (Modra črta) se bo postopoma zmanjševal, saj bo del tega disociit za proizvodnjo molekul NO2. Tako je koncentracija št2, [Ne2] (rdeča črta), enaka nič na začetku, se bo kmalu povečala, ko se n2Tudi4 Disociirano.
Vendar je to reverzibilna reakcija: del molekul NO2 Pridružili se bodo, da se oblikujejo n2Tudi4. Bosta torej dve reakciji, neposredni in obratni, vsak s svojimi hitrostmi.
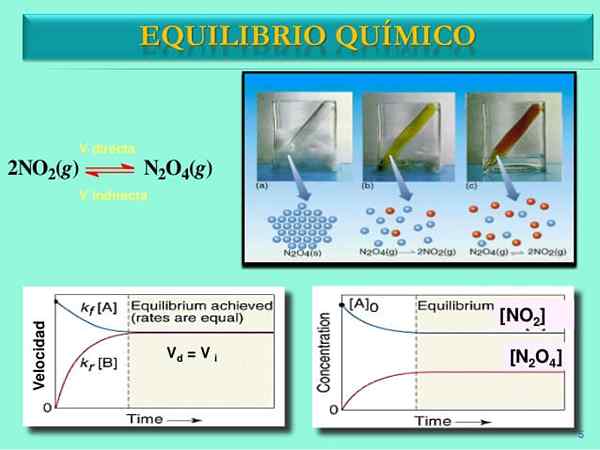 Vir: Slideshare.mreža
Vir: Slideshare.mreža Reakcijske hitrosti
Sprva je hitrost porabe n2Tudi4 je večja od hitrosti porabe2. Očitno je, da ima samo n2Tudi4, Nekaj molekul, ki so nastale iz2 Komaj se znajdejo, da se odzovejo. Na tej točki se bo viala začela mravljin po oranžni, ker obstaja mešanica N2Tudi4 in ne2.
Malo po malo, saj je več molekul št2 Na cesti in da N molekule2Tudi4 Disocirajo se, hitrosti obeh reakcij se bodo ujemale, tudi če se koncentracije med seboj razlikujejo. Se pravi, ne2] je ponavadi večji od [n2Tudi4], zato je rdeča črta nad modrikasto črto.
Vam lahko služi: fizikalno -kemijske lastnostiUpoštevajte, da hitrost postane DC/DT, to je sprememba koncentracije glede na čas. Zato dva C proti. t in V VS. T niso enaki.
Na ravnovesju
Enkrat par n2Tudi4-Ne2 Nastavite ravnotežje, hitrosti obeh reakcij se ujemajo in dobimo naslednje matematične izraze:
Vneposredno = k1[N2Tudi4]
Vvzvratno = k-1[Ne2]2
Vneposredno = Vvzvratno
k1[N2Tudi4] = k-1[Ne2]2
k1/k-1 = [Ne2]2/ [N2Tudi4]
KEq = [Ne2]2/ [N2Tudi4]
V tem trenutku bo cesta barvana celo bolj kot rjava, saj je ravnovesje bolj usmerjeno v oblikovanje [ne2]. To je, kEq, Ravnotežna konstanta mora biti večja od 1 ob upoštevanju večjega razmerja [ne2]2/ [N2Tudi4].
V koncentracijah ravnotežja [n2Tudi4] in ne2] Ostajata konstantna, obe reakciji se zgodita z isto hitrostjo: določena količina N je samo disociirana2Tudi4, Isti znesek bo nastal takoj zaradi reakcije določene količine št2.
Zaradi tega se pravi, da je kemično ravnovesje dinamično: molekule n2Tudi4 in ne2 Še vedno sodelujejo v reakcijah, tudi če se v njihovi koncentraciji ne spreminjajo.
In so enake reakcijske hitrosti za oba čutila, rdeča in modrikasta črta v grafiki V VS. T igra na vodoravni črti.
Ravnotežna konstanta
Ravnotežna konstanta za prejšnjo reakcijo bo vedno enaka pri določeni temperaturi, ne glede na to, koliko n2Tudi4 se injicira na začetku v cesto. To bo tako, tudi če se neposredno vbrizga mešanica N2Tudi4 in ne2, nato pustite v mirovanju, dokler ravnotežje ne doseže.
Ko dosežete ravnovesje in se meri koncentracije [n2Tudi4] in ne2], odnos [ne2]2/ [N2Tudi4] bo dal enako k KEq Za to reakcijo. Večji kot je (keq >> 1), več izdelkov bo v ravnovesju. In manjši (keq << 1), más reactivos habrá en el equilibrio.
Koncentracije [n2Tudi4] in ne2] Ne bodo vedno. Na primer, če se v vialo vbrizgajo majhni količini ali če jim nasprotno vbrizgajo hudourniki teh plinov v reaktor, se bodo količine precej spreminjale. Vendar kEq Ostala bo enaka, dokler je temperatura v obeh procesih enaka.
KEq Je dovzetna za temperaturne spremembe: pri višji temperaturi bo večja vrednost. To je pri višji temperaturi v ravnovesju. To je tako, razen če je reakcija eksotermična, kot bo razloženo v naslednjem razdelku.
Dejavniki, ki vplivajo na kemično ravnovesje
Dejavniki, ki vplivajo na kemično ravnovesje v reverzibilni reakciji, so: koncentracija, tlak in temperatura.
- Koncentracija
V reverzibilni reakciji bo po načelu Le Chatlierja s povečanjem koncentracije reagenta prišlo do premika kemičnega ravnovesja na desno, da se poveča koncentracija reakcijskih produktov.
Nasprotno, če se reakciji doda produkt, se bo kemično ravnovesje premaknilo v levo, da se poveča koncentracija reagentov. Če je kot primer vzeta naslednja reakcija:
C (s) +o2(g) ⇌ 2 Co (g)
S povečanjem koncentracije reagentov (C in O2), Ravnotežje se bo premaknilo v desno, to je v smeri nastajanja izdelka ogljikovega monoksida (CO). Toda povečanje koncentracije CA bo povzročilo premik ravnotežja na levo, da bi povečali koncentracijo C in O2.
Lahko vam služi: karbonilna skupina: značilnosti, lastnosti, nomenklatura, reaktivnost- Pritisk
V reakciji, ki je bila razvita v plinski fazi, bo sprememba volumna ali tlaka, ki se izvaja na plini, ki sodelujejo v njem.
Če imajo komponente reakcije (reagenti in produkti) razlike v številu molov, vključenih v reakcijo, na primer dimerizacija dušikovega dioksida (št2)::
2 Ne2(g) ⇌2Tudi4(g)
Povečanje tlaka, ki se izvaja na reakciji v plinski fazi, posledica zmanjšanja ali ne v volumnu reakcije. V tem primeru: izdelek n2Tudi4.
Nasprotno, znižanje tlaka bo povzročilo premik ravnotežja na stran reakcije, ki ima največ molov plina. V danem primeru se bo premaknil proti reagentom (ne2), Da bi preprečili znižanje tlaka.
Če so v fazni reakciji sode, moli reagentov so enaki molom produktov, spremembe tlaka ne bodo vplivale na kemično ravnovesje.
- Temperatura
Endotermična reakcija
V endotermični reakciji lahko toploto obravnavamo kot reagent, saj je njegova oskrba potrebna, da se reakcija pojavi:
A +Q ⇌ B
Q = dobavljena toplota
Zato se bo v endotermični reakciji, ko se temperatura zviša, ravnovesje premakni v desno. Medtem, ko se temperatura zniža, se ravnotežje premakne v levo.
Vročina je del reagentov, da bi jo porabila za preoblikovanje v B.
Eksotermična reakcija
V eksotermični reakciji nastane toplota, kar je produkt reakcije:
A ⇌ b +q
V eksotermični reakciji, ko se temperatura zvišuje, se bo ravnotežje premaknilo na levo (reagenti), saj se proizvodnja toplote povečuje. Medtem, ko se temperatura zniža, se bo ravnotežje premaknilo v desno (izdelki).
Vročina je del izdelkov, ko se temperatura poveča, ne bo treba prispevati več toplote v okolje. In zato bo ravnovesje prizadevalo izkoristiti dodatno toploto za proizvodnjo več reagentov; V tem primeru več kot.
Vrste kemične bilance
Odvisno od fizičnega stanja reakcijskih komponent je kemično ravnovesje lahko homogeno ali raznolike.
Homogeno ravnovesje
V tej vrsti ravnotežja, vse Reagenti in izdelki imajo isto fazno ali tekoče stanje. Na primer:
N2(g) +3 h2(g) ⇌ 2 NH3(g)
Tu je tako2, kot h2 in NH3 So plinaste snovi.
Heterogeno ravnovesje
Obstaja, kdaj ne vsi Reagenti in izdelki imajo isto fazno ali fizično stanje. Na primer:
2 Nahco3(s) ⇌ na2Co3(s) +co2(g) +h2O (g)
Tu imamo nahco3 in na2Co3 kot trdne snovi in co2 in h2Ali kot plini ali hlapi.
Primeri kemičnega ravnovesja
Disociacija ocetne kisline v vodi
Ocetna kislina, cho3COOH, disociativa v vodi, ki vzpostavlja ravnotežje:
Pogl3COOH (AC) + H2Ali (l) ⇌ cho3COO-(Ac) + h3Tudi+(AC)
Reakcija, katere ravnotežna konstanta se imenuje kislost konstanta.
Izomerizacijatudin od butana
Plin n-Butano lahko izomeriziramo po naslednji reverzibilni reakciji za proizvodnjo izomera izomera:
Pogl3Pogl2Pogl2Pogl3(g) ⇌ cho3Ch (pogl3)2(g)
Tvorba dušikovega oksida v atmosferi
V atmosferi se lahko oblikuje dušikov oksid, čeprav zelo komaj, iz dušikovega in zračnega kisika:
N2(g) + oz2(g) ⇌ 2No (g)
Lahko vam služi: kaj je miliequiventente? (Primeri izračuna)KEq Iz te reakcije je 2,10-31 pri 25 ° C, tako da se bo oblikovala zaničevalna količina.
ReakcijatudiN srebrne komprecirane z amonomYoAC
Srebrni ioni, AG+, Z amoniakom jih je mogoče dokončati v skladu z naslednjo reverzibilno reakcijo:
Ag+(Sonce) + 2nh3(L) ⇌ [Ag (NH3)2]+(Sonce)
Rešene vaje
Vaja 1
Kakšna vrsta kemičnega ravnovesja ustreza naslednji reakciji?
2nocl (g) ⇌ 2No (g) + cl2(g)
Ta reakcija ustreza homogenemu ravnovesju, saj vse vpletene snovi, NOCL, NO in CL2, So plini.
Vaja 2
Za isto reakcijo od zgoraj bi lahko pričakovali spremembo ravnotežja, če bi se tlak nenadoma povečal?
Preštejmo mole reagentov:
2Nocl
Imamo 2 mola NOCL. Zdaj pa povejmo moli izdelkov:
2No + Cl2
Imamo tri mole: dva od in enega od CL2. Na strani izdelkov je več plinastih molov. Zato se bo povečanje tlaka povzročilo, da se ravnovesje premakne na levo stran, proti tvorbi NOCL. Na ta način si sistem prizadeva zmehčati učinke pritiska, ki daje prednost tvorbi NOCL in ne NO in CL2.
Vaja 3
Za isto reakcijo od zgoraj predpostavimo, da se nenadoma vbrizga precejšen volumen CL2. Kaj se bo zgodilo z ravnotežjem?
Ko dodajate CL2 do reaktorja ali posode se njegova koncentracija povečuje kot produkt reakcije. In zato se bo ravnotežje premaknilo nazaj v levo, da bi oblikovalo več NOCL.
Vaja 4
Če ima disociacija NOCL pri 227 ° C 4 ravnotežno konstanto 4.5 · 10-4, V katero smer je bila ravnotežja?
Spet biti kEq manj kot 1 (4.5 · 10-4 < 1), en el equilibrio se espera que haya más NOCl que NO o Cl2, Ker je razseljen na levo.
Vaja 5
Glede na naslednjo reakcijo v ravnovesju:
[Co (oh2)6]2+(AC) +4Cl-(AC) +Q ⇌ [COCL4]2-(AC) +6H2Ali (l)
In vedeti, da je kompleks [co (oh2)6]2+ Je roza in da je kompleks [cocl4]2- Je modrikasto, kakšne spremembe bi pričakovali, če segrejete posodo s [co (oh2)6]2+? Kaj bi pričakovali, ali bi jo po ogrevanju posode postavil v kopalnico z ledom?
Reakcija je endotermična, saj absorbira toploto kot reagent. Zato pri segrevanju posode s [CO (OH2)6]2+, Ravnotežje se bo premaknilo v desno, proti tvorbi [COCL4]2-. Bluist roza barvna sprememba bo.
Potem, če je modrikasto barvno posodo s [cocl4]2- Postavljen je v kopalnico z ledom, reakcija se bo zdaj premaknila v levo, proti tvorbi Co (OH2)6]2+:
[COCL4]2-(AC) +6H2Ali (l) ⇌ [co (oh2)6]2+(AC) +4Cl-(Ac) +q
To je zato, ker je obratna reakcija eksotermična, saj ima toplota, ki je kot izdelek. Zato pri hlajenju posode s [cocl4]2- Modra, kompleks [co (oh (oh2)6]2+, In roza barva se bo znova pojavila.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Emedicinska pripravlja. (s.F.). Vrste ravnotežja. Okreval od: emedicprep.com
- Lumen brezmejna kemija. (s.F.). Dejavniki, ki so aficirali kemično ravnovesje. Obnovi se od: tečajev.Lumenarning.com
- Wikipedija. (2020). Kemično ravnovesje. Pridobljeno iz: v.Wikipedija.org
- Kemija librettexts. (24. maja 2020). Equiqubrium izračuni - pod ilustrativnim izgledom. Okrevano od: kem.Librettexts.org
- Meyers Amy. (2020). Ravnotežje: kemično in dinamično. Študij. Okrevano od: študij.com
- Čelada, Anne Marie, ph.D. (11. februar 2020). Kemično ravnovesje v kemičnih reakcijah. Okreval od: Thoughtco.com
- « Gvatemala kulture značilnosti, tradicije in običaji
- Temeljna elektroforeza, tehnika, za kaj je, primeri »

