Reakcijska entalpija, termokemija, vaje

- 4757
- 994
- Adrian Legros
The reakcijska entalpija Gre za termodinamično funkcijo, ki vam omogoča izračun pridobljene ali dostave toplote v kemično reakcijo, pod pogojem, da je ta reakcija prišla pri konstantnem tlaku. Opredeljen je kot notranja energija ali plus produkt tlaka P glede na prostornino V snovi, ki sodelujejo v kemični reakciji, kot sledi: H = U + P ∙ V
Zato ima entalpija dimenzije energije, v mednarodnem sistemu ukrepov pa se meri v Joulesu. Za razumevanje odnosa entalpije s toploto, izmenjano v kemični reakciji, je treba zapomniti prvi zakon termodinamike, ki določa naslednje: Q = ΔU + W
 Slika 1. Pri zgorevanju plina se entalpija zmanjša. Vir: Pixabay
Slika 1. Pri zgorevanju plina se entalpija zmanjša. Vir: Pixabay Prvi zakon določa, da je toplota, izmenjana v termodinamičnem procesu.
V katerem koli postopku se delo izračuna z naslednjim razmerjem:

V prejšnjem izrazu je VI začetni volumen, vf končni volumen in p tlak. Če se postopek izvaja pod konstantnim tlakom P, bo posledično delo:
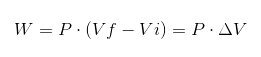
Kjer je ΔV spreminjanja glasnosti.
[TOC]
Opredelitev
Kemične reakcije so termodinamični procesi, ki se na splošno pojavljajo pod konstantnim tlakom in zelo pogosto pri atmosferskem tlaku. Ta vrsta termodinamičnih procesov se imenuje "izobaric", saj se pojavlja pri stalnem tlaku.
V tem primeru lahko prvi zakon termodinamike napišemo tako:
Qp = ΔU + p ∙ ΔV
Kjer QP kaže, da je bila toplota izmenjana pri stalnem tlaku. Če je definicija entalpije h = u + p ∙ v pridobljena, potem:
QP = ΔH
Od tam morate spremeniti pozitivno entalpijo, kaže na reakcijo, ki je odvzela toploto iz okolja. To je endotermična reakcija.
Vam lahko služi: tono: rešene transformacije, enakovrednosti in vajeNasprotno, če je sprememba entalpije negativna, je potem eksotermična reakcija.
Pravzaprav beseda entalpija izvira iz grške besede Entalpien, čigar pomen je "toplota".
Pogosto se entalpija imenuje tudi toplota. Vendar mora biti jasno, da ni isto kot toplota, ampak izmenjava toplote med termodinamičnim postopkom spreminja entalpijo.
Toplotni odnos
Za razliko od toplote je entalpija stavna funkcija. Ko se izračuna sprememba entalpije, se izračuna razlika dveh funkcij, ki sta odvisna izključno od stanja sistema, kot sta notranja energija in količina.
ΔH = ΔU + P ∙ ΔV
Kot v reakciji ostane tlak konstanten, je tudi reakcijska entalpija stanja, ki je odvisna le od notranje energije in volumna.
V kemijski reakciji je mogoče entalpijo reagentov opredeliti kot vsoto vsakega od njih; in izdelke kot vsota entalpije vseh izdelkov.
Sprememba entalpije v reakciji je razlika v proizvodih, razen reagentov:

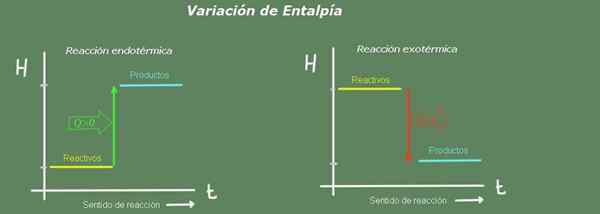 Slika 2. Diagram entalpije. Vir: Self Made.
Slika 2. Diagram entalpije. Vir: Self Made. V endotermični reakciji je entalpija produktov večja kot pri reagentih; to pomeni, da reakcija odvzame toploto iz okolja. Nasprotno, v eksotermični reakciji je entalpija reagentov večja kot pri produktih, saj reakcija daje toploto okolju.
Standardna entalpija
Ker je sprememba entalpije v kemični reakciji lahko odvisna od tlaka in temperature, je običajno določiti standardne reakcijske pogoje:
Lahko vam služi: kalibracijska krivulja: za kaj je, kako to storiti, primeriStandardna reakcijska temperatura: 25 ° C.
Standardni reakcijski tlak: 1 atm = 1 bar.
Standardna entalpija je označena na naslednji način: H °
Termokemija
V termokemični enačbi ne samo snovi reagentov in izdelkov, je pomembna tudi variacija entalpije. Entalpija se razume kot reakcija na spremembo nje, ki je imela mesto med istim.
Kot primer si oglejmo naslednje reakcije:
2 H2 (plin) + O2 (plin) → 2 H2O (tekočina); ΔH ° = -571,6 kJ (eksotermično).
H2 (plin) + (½) O2 (plin) → H2O (tekočina); ΔH ° = -285,8 kJ (eksotermično).
2 H2O (tekočina) → 2 H2 (plin) + O2 (plin); ΔH ° = +571,6 kJ (endotermična).
Entalpija je obsežna termodinamična količina
Če se pogoji kemične enačbe pomnožijo ali delijo z določenim faktorjem, se entalpija pomnoži ali deli z njo.
Če je reakcija vložena, se vloži tudi znak reakcijske entalpije.
Rešene vaje
-Vaja 1
C2H2 acetilenski plin dobimo iz reakcije kalcijevega karbida CAC2, ki je na zrnten način z vodo v okolju in okoljskem tlaku.
Kot podatki obstajajo entalpije tvorbe reagentov:
ΔH ° (CAC2) = -59,0 kJ/mol
ΔH ° (H20) = -285,8 kJ/mol
In entalpija tvorbe izdelkov:
ΔH ° (C2H2) = +227,0 kJ/mol
ΔH ° (Ca (OH) 2) = -986,0 kJ/mol
Poiščite standardno entropijo reakcije.
Rešitev
Prva stvar je povečati uravnoteženo kemijsko enačbo:
CAC2 (S) + 2H20 (L) → CA (OH) 2 (S) + C2H2 (g)
In zdaj entalpije reagentov, produktov in reakcije:
- Reagenti: -59,0 kJ/mol -2 ∙ 285,8 kJ/mol = -630,6 kJ/mol
- Izdelki: -986,0 kJ/mol + 227,0 kJ/mol = -759 kJ/mol
Lahko vam služi: kaj so koplanares vektorji? (Z rešenimi vajami)- Reakcija: ΔH ° = -759 kJ/mol -( -630 kJ/mol) = -129 kJ/mol
Gre za eksotermično reakcijo.
-Vaja 2
Ko 1 liter acetilena gori v standardnih pogojih, koliko toplote se odcepi?
Rešitev
Reakcija zgorevanja acetilena, ko je bila uravnotežena, je takšna:
C2H2 (g) + (5/2) O2 (g) → 2 CO2 (g) + H20 (L)
Potrebujemo entalpije usposabljanja izdelkov:
ΔH ° (CO2) = -393,5 kJ/mol
ΔH ° (H2O (L)) = -285,8 kJ/mol
Izračun entalpij
S temi podatki lahko izračunamo entalpijo izdelkov:
ΔH ° (izdelki) = 2*(-393,5 kJ/mol) + (-285,8 kJ/mol) = -1072,8 kJ/mol
In entalpija tvorbe reagenta:
ΔH ° (C2H2) = 227,0 kJ/mol
ΔH ° (O2) = 0,0 kJ/mol
Entalpija reagentov bo:
227,0 kJ/mol + (5/2)* 0,0 = 227,0 kJ/mol
Entalpija molarne reakcije bo: ΔH ° (produkti) - ΔH ° (reagenti) = -1072.8kJ/mol - 227,0 kJ/mol = -1299,8 kJ/mol
Entalpija zgorevanja
Zdaj moramo vedeti, koliko molov acetilena je liter acetilena v standardnih pogojih. Za to bomo uporabili državno enačbo idealnega plina, iz katere bomo očistili število molov.
Število molov n = p*v/(r*t)
P = 1 atm = 1,013 x 10⁵ pa
V = 1 l = 1,0 x 10^-3 m³
R = 8,31 j/(mol*k)
T = 25 ° C = 298,15 K
N = 0,041 mol
Entalpija zgorevanja 1 litra acetilena je 0,041 mol * (-129,8 kJ/mol) = -53,13 kJ
Negativni znak kaže, da gre za eksotermično reakcijo, ki oddaja 53,13 kJ = 12,69 kcal.
Reference
- Castaños e. Entalpija v kemičnih reakcijah. Okrevano od: lidiaconlachimica.WordPress.com
- Termokemija. Reakcijska entalpija. Pridobljeno iz: Viri.izobrazba.je
- Termokemija. Opredelitev standardne reakcijske entalpije. Okreval od: quimitube.com
- Wikipedija. Standardna reakcijska entalpija. Okreval od: Wikipedia.com
- Wikipedija. Trening entalpija. Okreval od: Wikipedia.com
- « Relativne formule napak, kako se izračuna, vaje
- Kaj je prizadevanje za dodelitev in kako ga pridobiti? »

