Elektronegativnost
- 690
- 150
- Ignacio Barrows
Kaj je elektronegativnost?
The Elektronegativnost To je relativna periodična lastnost, ki zadeva sposobnost atoma privabljanja elektronske gostote njegovega molekularnega okolja. To je trend atoma, ki privabi elektrone zase, ko je pritrjen na molekulo. To se odraža v obnašanju številnih spojin in o tem, kako medmolekularno medsebojno delujejo.
Z drugimi besedami, bolj kot je elektronegativen atom, večja je sposobnost privabljanja elektronov drugih atomov; Imel bo tudi večji ionizacijski potencial, ki vam omogoča, da svoje elektrone vzdržujete pred zunanjo privlačnostjo, hkrati pa privabite elektrone okoliških atomov.
Zdaj vsi elementi v isto stopnjo pritegnejo elektrone sosednjih atomov. V primeru tistih, ki dajejo elektronsko gostoto, se reče, da so Elektropozitivno, Medtem ko so tisti, ki "pokrivajo" elektrone Elektronegativi. Obstaja veliko načinov za razlago in opazovanje te lastnosti (ali koncepta).
Na primer, v zemljevidih elektrostatičnih potencialov za molekulo (na primer klor dioksid nadrejene slike, CLO2) Opazimo učinek različnih elektronegativnosti za atome klora in kisika.
Rdeča barva označuje območja, bogata z elektroni molekule, Δ- in modre barve, ki so slaba elektronov, δ+. Tako se lahko po vrsti računskih izračunov vzpostavijo tovrstno zemljevide; Mnogi od njih kažejo neposredno razmerje med lokacijo elektronegativnih atomov in δ-.
Prav tako je mogoče vizualizirati na naslednji način: Znotraj molekule je bolj verjetno, da se tranzit elektronov pojavi v bližini najbolj elektronegativnih atomov.
Iz tega razloga je za CLO2 Atomi kisika (rdeče kroglice) so obdani z rdečim oblakom, medtem ko je klor atom (zelena krogla) modrikastega oblaka.
Opredelitev elektronegativnosti je odvisna od pristopa, ki ga daje pojav, obstaja več lestvic, ki upoštevajo iz različnih vidikov. Vendar imajo vse lestvice skupno, da jih podpira notranja narava atomov.
Lestvice elektronegativnosti
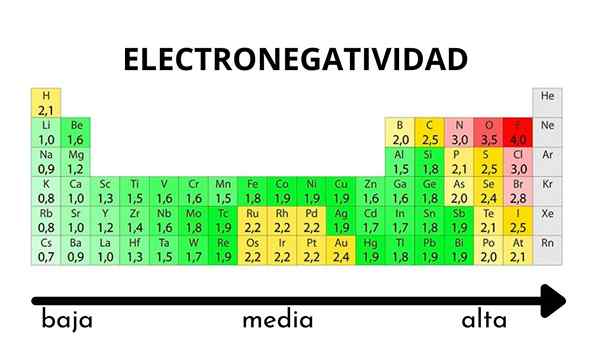
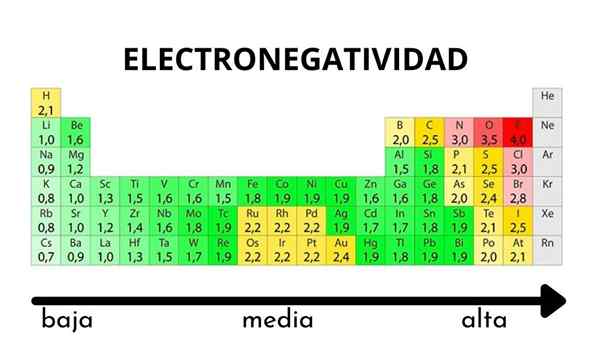 V periodični tabeli jo lahko opazimo, ko se vrednost elektronegativnosti poveča ali zmanjša
V periodični tabeli jo lahko opazimo, ko se vrednost elektronegativnosti poveča ali zmanjša Elektronegativnost ni lastnost, ki jo je mogoče količinsko ovrednotiti, niti nima absolutnih vrednosti. To je zato, ker trend atoma privabljanja elektronske gostote do njega ni enak v vseh spojinah. Z drugimi besedami: elektronegativnost se razlikuje glede na molekulo.
Če za molekulo CLO2 Atom CL se bo spremenil v N, potem pa bi bila spremenjena tudi težnja ali privabljanja elektronov; Lahko ga povečate (dobite rdeči oblak) ali zmanjšate (izgubite barvo). Razlika bi bila v novi N-O povezavi, da bi imeli molekulo O-N-O (dušikov dioksid, št2).
Lahko vam služi: odnos kemije in tehnologije s človekom, zdravjem in okoljemKer elektronegativnost atoma ni enaka za vse molekularno okolje, jo je treba določiti v skladu z drugimi spremenljivkami. Na ta način obstajajo vrednosti, ki služijo kot referenca in ki omogočajo napovedovanje, na primer vrsta povezave, ki se oblikuje (ionska ali kovalentna).
Pauling lestvica
Veliki znanstvenik in dobitnik dveh Nobelovih nagrad, Linus Pauling (1901-1994), je leta 1932 vzgojil kvantitativno (merljivo) obliko elektronegativnosti, znane kot Pauling lestvica. V njem je bila elektronegativnost dveh elementov, A in B, ki tvorita povezave, povezana z dodatno energijo, povezano z ionskim značajem povezave A-B.
Teoretično so kovalentne vezi najbolj stabilne, saj je porazdelitev njihovih elektronov med dvema atoma pravična; to pomeni, da za molekule A-A in B-B oba atoma delita vezi elektrone na enak način. Če pa je A bolj elektronegativen, bo omenjeni par več kot B.
V tem primeru A-B ni več popolnoma kovalenten, čeprav se njene elektronegativnosti ne razlikujejo veliko, lahko rečemo, da ima njegova povezava visok kovalenten značaj. Ko se to zgodi, povezava doživi majhno nestabilnost in pridobi dodatno energijo kot produkt razlike v elektronegativnosti med A in B.
Večja kot je ta razlika, bolj je energija povezave A-B in posledično večji je ionski značaj omenjene povezave.
Ta lestvica predstavlja največ, ki se uporablja v kemiji, vrednosti elektronegativnosti pa so izhajale iz razporeditve vrednosti 4 za atom fluora (element z najnižjo elektronegativnostjo je Cessium, z 0,7). Od tam so lahko izračunali to od drugih elementov.
Mulliken lestvica
Medtem ko je Pauling lestvica povezana z energijo, povezano s povezavami, je lestvica Robert Mulliken (1896-1986) bolj povezana z dvema drugim periodičnim lastnostim: ionizacijsko energijo (EI) in elektronsko afiniteto (AE).
Tako je element z visokimi vrednostmi EI in AE zelo elektronegativen, zato bo pritegnil elektrone iz svojega molekularnega okolja.
Ker? Ker odraža, kako težko je "zagnati" zunanji elektron in kako stabilen anion, ki je nastal v plinski fazi, je tako stabilen. Če imata obe lastnosti velike velikosti, je element "ljubimec" elektronov.
Vam lahko služi: fuzijaMulliken Elektronegativnosti se izračunajo z naslednjo formulo:
ΧM = ½ (ei + ae)
To je, χM Je enak povprečni vrednosti EI in AE.
Vendar je za razliko od lestvice Pauling, ki je odvisna od povezave z atomi, povezana z lastnostmi države Valencia (s svojimi najbolj stabilnimi elektronskimi konfiguracijami).
Obe lestvici ustvarjata podobne vrednosti elektronegativnosti za elemente in se približno nanašata na naslednjo pretvorbo:
ΧStr = 1.35 (χM)1/2 - 1.37
Oba xM kot xStr So brezdimenzijske vrednosti; to pomeni, da jim primanjkuje enot.
Lestvica a.L. Allred in e. Rochow
Obstajajo še druge lestvice elektronegativnosti, kot sta Sanderson in Allen. Vendar je tista, ki sledi prva dva, lestvica Allred in Rochow (χAr). Ta lestvica temelji na učinkoviti jedrski obremenitvi, ki jo doživlja elektron na površini atomov. Zato je neposredno povezan s privlačno silo jedra in učinkom zaslona.
Kako se razlikuje elektronegativnost v periodični tabeli?
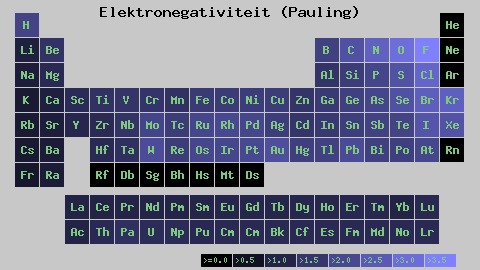 Pauling lestvica elektronegativnosti. Vir: Wikimedia Commons
Pauling lestvica elektronegativnosti. Vir: Wikimedia Commons Ne glede na lestvice ali vrednosti, ki jih ima, se elektronegativnost za nekaj časa poveča z desne proti levi in od spodaj navzgor v skupinah. Tako se poveča proti zgornji desni diagonali (ne šteje helija), dokler fluor ni.
Na vrhunski sliki je sveže rekel. V periodični tabeli se Pauling Elektronegativnosti izražajo v skladu z barvami škatel. Ker je fluorid najbolj elektronegativen, je odvisen od bolj grobe vijolične barve, medtem ko manj elektronegativne (ali elektropozitivne) barve temnejše.
Vidimo tudi, da skupinske glave (H, BE, B, C itd.) Imajo najjasnejše barve, in ker se skupina spušča z drugimi elementi. Za kaj je to? Odgovor je spet v lastnostih EI, AE, ZEF (učinkovita jedrska obremenitev) in na atomskem polmeru.
Atom v molekuli
Posamezni atomi imajo resnično jedrsko z in zunanji elektroni trpijo učinkovit produkt jedrske obremenitve zaščitnega učinka.
Ko se premika v obdobju, se Zef povečuje tako, da se atom pogodbeni; to pomeni, da se atomski radijski sprejemniki v določenem obdobju zmanjšajo.
To ima za posledico, da bodo v času povezovanja enega atoma z drugim elektroni "pretakali" z atomom z večjim zefom. Tudi to daje ionski značaj povezavi, če obstaja izrazit trend elektronov, ki gredo na atom. Ko ne, se govori o pretežno kovalentni vezi.
Vam lahko postreže: vijolično stekloZaradi tega se elektronegativnost razlikuje glede na atomske radijske sprejemnike, ZEF, ki so tesno povezani z EI in AE. Vse je veriga.
Uporabnost elektronegativnosti
Elektronegativnost načeloma služi, da ugotovi, ali je binarna spojina kovalentna ali ionska. Kadar je razlika v elektronegativnosti zelo visoka (s hitrostjo 1.7 enot ali več) Govori se, da je spojina ionska.
Koristno je tudi razbrati v strukturi, katere regije bodo morda bogatejše v elektroni.
Od tu je mogoče predvideti, kateri mehanizem ali reakcija lahko trpi spojino. V slabih regijah elektronov, Δ+, je možno, da negativno nabiti vrste, pridobljene na določen način; In v regijah, bogatih z elektroni, lahko njihovi atomi na zelo specifične načine delujejo z drugimi molekulami (interakcije dipole-dipolo).
Primeri (klor, kisik, natrij, fluorid)
Kakšne so vrednosti elektronegativnosti za atome klora, kisika, natrija in fluora? Po fluoridu je kdo najbolj elektronegativen? Z uporabo periodične tabele opazimo, da ima natrij temno vijolično barvo, medtem ko sta kisikove barve in klor vizualno zelo podobni.
Njihove vrednosti elektronegativnosti za lestvice Pauling, Mulliken in Allred-Rhow so:
Na (0.93, 1.21, 1.01).
Ali (3.44, 3.22, 3.petdeset).
Cl (3.16, 3.54, 2.83).
F (3.98, 4.43, 4.10).
Upoštevajte, da je s številčnimi vrednostmi razlika med negativnostmi kisika in klora.
Po Mullikenovi lestvici je klor bolj elektronegativen kot kisik, za razliko od tehtnic Pauling in Allred-Rhochow. Razlika v elektronegativnosti med obema elementoma je še bolj očitna z uporabo lestvice Allred-Rhow. In končno je fluorid, ne glede na izbrano lestvico, najbolj elektronegativen.
Kjer je atom F v molekuli, pomeni, da bo povezava imela visok ionski značaj.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja., str. 30 in 44). MC Graw Hill.
- Jim Clark. (2000). Elektronegivnost. Vzet od: Chemguide.co.Združeno kraljestvo
- Anne Marie Helmerine, ph.D. (11. december 2017). Opredelitev in primer elektronegatenosti. Vzeto od: Thoughtco.com
- Oznaka e. Tuckerman. (5. november 2011). Lestvica elektronegatske lestvice. Vzet od: NYU.Edu
- Wikipedia (2018). Elektronegativnost. Vzet od: je.Wikipedija.org

