Močan koncept elektrolitov, značilnosti, primeri

- 2055
- 111
- Barry Ernser
A Močan elektrolit Vse je tisto, kar se snov, ki se raztopi v vodi ali v določenem topilu, popolnoma disociirana na ionih. Zato ne bi smelo biti raztopine kot nevtralne molekule ali kot netopne trdne snovi. Močan elektrolit je lahko sol, kislina ali baza, pod pogojem, da se disociirajo ali popolnoma ionsko.
Najbolj reprezentativen primer elektrolita je običajna sol, natrijev klorid, NACL. V vodni raztopini se NaCl kristali v celoti ločijo, da proizvajajo ione NA+ in Cl-, ki se na koncu obkrožajo molekule vode. Nato se reče, da se sol obnaša kot močan elektrolit, ko je njena topnost zelo velika v vodi.
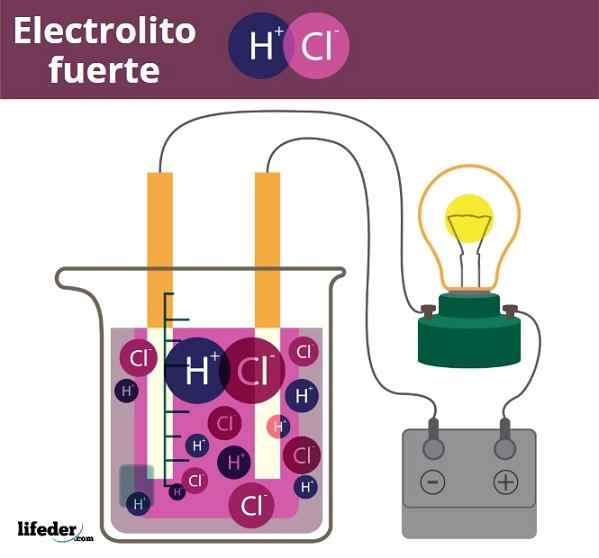 Primer Fuero Electrolit. HCl, klorovodikova kislina, sprosti ioni H3O+ in CL-
Primer Fuero Electrolit. HCl, klorovodikova kislina, sprosti ioni H3O+ in CL- Nekoliko podoben je primer kislin in baz. Ko so te močne, njihove rešitve v vodi proizvajajo največjo možno količino H ionov3Tudi+ ali oh-, Torej so spremembe pH nenadne. Primeri močnih kislin in baz so dušikova kislina, hno3, in kalijev hidroksid, koh.
Pomembno je vedeti, kako prepoznati močne elektrolite pri pripravi zelo ionskih raztopin ali zelo močnih kislin ali osnovnih sredstev.
[TOC]
Značilnosti močnih elektrolitov
Topnost
Za močne elektrolite so značilne, da so izjemno topne vodne snovi. Ne glede na to, ali je trdna ali plina. Če je sol, na primer, v vodi malo topna, lahko zavržemo kot močan elektrolit.
Ionska prevodnost
Močni elektroliti niso le zelo topni v vodi, ampak tudi ustvarijo veliko število ionov. Zahvaljujoč električnim stroškom teh ionov lahko elektroni udobno potujejo po rešitvah. To se odraža v povečanju ionske prevodnosti glede na čisto vodo. Zato ionske rešitve zelo dobro vodijo elektriko.
Vam lahko služi: klor: zgodovina, lastnosti, struktura, tveganja, uporabeSlana nevtralnost
Številni fiziološki močni elektroliti, ko se raztapljajo v vodi, ne povzročajo nobene spremembe pH. To pomeni, da rešitve teh soli niso kisle ali osnovne, ampak nevtralne, s pH blizu 7.
Vendar pa lahko obstajajo kisline ali osnovne soli, ki se zlahka raztopijo v vodi, ki ustvarjajo tudi popolne ione. Na primer natrijev karbonat2Co3, se raztopi za ustvarjanje Na ionov+ in co32-, Toda pH raztopine je osnovni.
Primeri močnih elektrolitov
 Natrijev klorid je najbolj reprezentativen primer močnega elektrolita. Vir: Cristian V. /Cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0
Natrijev klorid je najbolj reprezentativen primer močnega elektrolita. Vir: Cristian V. /Cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0 Močni elektroliti, ki so toliko, so razdeljeni na tri klasifikacije: močne kisline, močne baze in topne soli med nevtralizacijo med prvima dvema.
Močne kisline
Močne kisline pri raztapljanju v vodi, brez težav, morajo proizvesti največjo možno količino H3Tudi+, Torej mora biti kislina popolnoma ion; to pomeni, da ne sme obstajati kot nevtralna molekula s kislimi protoni, ne da bi se sprostili.
Primeri teh kislin so:
-HCl, klorovodikova kislina, sprošča H ione3Tudi+ in Cl-
-HF, fluorhorična kislina, sprošča H ione3Tudi+ in f-
-Hno3, Dušikova kislina, sprosti hones h3Tudi+ in ne3-
-Hclo4, perloška kislina, sprošča H ione3Tudi+ in clo4-
-Hio4, periódinska kislina, sprošča H ione3Tudi+ In io4-
-H2SW4, žveplova kislina, sprosti Hones H3Tudi+ In tako42-
Razlog, zakaj hidrium ion, h3Tudi+, Vedno je prisoten (tako ali drugače), to je zato, ker vodik, ki ga donirajo, prejme molekula vode:
HCl + H2O → h3Tudi+ + Cl-
Reakcija je neposredna in nepopravljiva. To je značilnost močne kisline, ki je posledično močan elektrolit zaradi njegove popolne ionizacije v vodi.
Vam lahko služi: alifatski ogljikovodiki: lastnosti, nomenklatura, reakcije, vrsteMočne baze
Močne baze, raztapljanje v vodi brez težav, morajo sprostiti OH ione- iz istih kristalov ali nepovratno nemirnost molekula vode, da jih ustvari.
Številne močne baze so sestavljene iz ionov in nemolekulskih trdnih snovi. Nekateri primeri teh baz, ki se obnašajo kot močni elektroliti, so:
-Lioh, litijev hidroksid, sprošča OH ione- in li+
-NaOH, natrijev hidroksid, sprošča OH ione- in na+
-RBOH, Rubidio hidroksid, sprošča OH ione- in RB+
-CA (OH)2, Kalcijev hidroksid, sprosti OH ioni- in ca2+
-Sr (oh)2, Stroncijev hidroksid, sprosti OH ioni- in g2+
-Ba (oh)2, Barijev hidroksid, sprosti OH ions- in ba2+
-Ne, natrijev hidrid, sprošča OH ione- in vodikov plin, h2
-Nanh2, natrij amiduro, sprosti OH ions- in amonijak plin, NH3
Greš ven
Hallobasi Močni elektroliti, ko se raztapljajo v vodi. Mnogi od njih ne proizvajajo pH sprememb. To je zato, ker so njihovi ioni zelo stabilni, zato ne sodelujejo v hidrolizi, da bi spremenili naravo vode. Primeri teh soli so:
-NaCl, natrijev klorid, sprošča ione NA+ in Cl-
-Agno3, Srebrni nitrat, sproščanje Ag ionov+ in ne3-
-Starejši brat3, natrijev nitrat, sprosti Na ioni+ in ne3-
-K2SW4, kalijev sulfat, sprošča k ione+ In tako42-
-MGCL2, Magnezijev klorid, sprošča Mg ione2+ in Cl-
-Cuso4, CuPric sulfat, sprošča ione cu2+ In tako42-
-KBR, kalijev bromid, sprošča K ione+ in br-
-Nh4CL, amonijev klorid, sprošča NH ione4+, Cl-, H3Tudi+ in amoniak plin
Lahko vam služi: živosrebrni klorid (ii): struktura, lastnosti, pridobivanje, uporabe-Nacn, natrijev cianid, sprošča ione NA+ in CN-
-Na3Po4, Natrijev fosfat sprošča ione NA+ in po43-
-Crcl3, Kromni klorid, sprošča cr ione3+ in Cl-
-Aub3, Auric Bromid, sprošča au ione3+ in br-
-Snso4, Estany sulfat, sprošča ione sn2+ In tako42-
NH4CL je nasprotujoči si primer: popolnoma je ioniziran, hkrati pa ustvarja amonijanske nevtralne molekule, ker je kisla sol.
Razlike med močnim in šibkim elektrolitom
Čeprav so bile razlike med močnim elektrolitom šibkega vzpostavljene posredno, bodo te predstavljene spodaj kot zaključek:
-Močni elektroliti so v vodah zelo topni; Šibki elektroliti niso.
-Ionizacija šibkega elektrolita je delna, kar pomeni, da lahko v raztopini obstajajo nevtralne molekule. Namesto tega močni elektroliti obstajajo izključno kot ioni.
-Šibke kisline in baze, ki so posledično šibki elektroliti, se ne ločujejo popolnoma v vodi, zato ustvarijo manj ionov H3Tudi+ ali oh- Kaj bi lahko pričakovali.
-Halth -halin močni elektroliti skoraj niso hidrolizirani v primerjavi s šibkimi elektroliti. Zato so raztopine prejšnjega ponavadi nevtralne, razen kadar se ukvarjajo s kislino ali osnovnimi solmi.
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Wikipedija. (2020). Močan elektrolit. Pridobljeno iz: v.Wikipedija.org
- Čelada, Anne Marie, ph.D. (11. februar 2020). Močna opredelitev in primer elektrolita. Okreval od: Thoughtco.com
- Chung & Chieh. (5. junij 2019). Elektroliti. Kemija librettexts. Okrevano od: kem.Librettexts.org
- « Zunanje ocenjevalne značilnosti, vrste (testi), primeri
- Platona biografija, filozofija in prispevki »

