Mehanizmi galvanske korozije, primeri, zaščita

- 2350
- 421
- Adrian Legros
The Galvanska ali elektrokemična korozija To je postopek, s katerim se kovina ali zlitina razgradi bolj vrtoglavo v primerjavi z njegovo konvencionalno oksidacijo. Lahko rečemo, da gre za pospešeno oksidacijo in celo namerno vodeno; kot v baterijah ali baterijah.
To se odvija pod vrsto pogojev. Najprej mora biti aktivna kovina, imenovana anoda. In drugič, mora biti malo reaktivna plemenita kovina, imenovana katoda. Tretji in četrti pogoj sta prisotnost medija, kjer se razširijo elektroni, kot so voda, in ionske ali elektrolitne vrste.
 Oksidirana železna krona. Vir: Pixnio.
Oksidirana železna krona. Vir: Pixnio. Galvanska korozija je opazna, zlasti v morskih okoljih ali na bregovih plaž. Zračni tokovi dvigujejo vodne pare mase, ki po drugi strani vlečejo nekatere ione; Slednji se na koncu prilepi na tanko plast vode ali kapljice, ki počivajo na kovinski površini.
Ti pogoji vlažnosti in slanosti dajejo prednost koroziji kovine. To pomeni, da bo železna krona, kot je tista na vrhunski sliki.
Enostavnost, ki jo bo morala kovina oksidirati v primerjavi z drugo, je mogoče kvantitativno izmeriti s svojimi potenciali za zmanjšanje; V Kemičnih knjigah je veliko tabel s temi potenciali in. Bolj negativno, večji je vaš nagib k oksidaciji.
Če je ta kovina v prisotnosti drugega z zelo pozitivnim redukcijskim potencialom, torej z velikim ΔE, bo oksidacija reaktivne kovine bolj agresivna. Pomembni so tudi drugi dejavniki, kot so pH, ionska sila, vlaga, prisotnost kisika in razmerje med območji kovine, ki je oksidira.
[TOC]
Mehanizmi
Koncepti in reakcije
Preden se lotite mehanizmov za galvansko korozijo, je treba razjasniti nekatere koncepte.
V reakciji Rédox vrsta izgubi elektrone (oksidirano), medtem ko jih drugi zmaga (zmanjša se). Elektroda, na kateri se oksidacija zgodi, se imenuje anoda; In na katerem se zgodi zmanjšanje, se običajno uporablja katoda (v angleščini se običajno uporablja nemočno pravilo REDCAT spomniti se).
Tako za elektrodo (en kos, vijak itd.) kovine m, če je to oksidirano, pravi, da gre za anodo:
M => mn+ + NE-
Število sproščenih elektronov bo enako obsegu pozitivne obremenitve kationa mn+ rezultat.
Nato druga elektroda ali kovina (obe kovini morata biti na nek način v stiku) prejme sproščene elektrone; Toda to ne trpi kemične reakcije, če pridobijo elektrone, saj bi jih le izvajali (električni tok).
Zato mora biti v rešitvi še ena vrsta, ki jo lahko ti elektroni formalno sprejmejo; Kot enostavno zmanjšati kovinske ione, na primer:
Vam lahko služi: nehomogeni sistemRn+ + NE- => R
To pomeni, da bi nastala plast kovine R in elektroda bi postala težja; Medtem ko bi kovina m izgubila maso, ker se njihovi atomi raztopijo.
Depolarizatorji
In če ne bi bilo dovolj kovinskih kationov? V tem primeru bodo druge vrste, prisotne na sredini, prevzele elektrone: depolarizadores. Te so tesno povezane s pH: o2, H+, Oh- in h2Tudi.
Elektroni za pridobivanje kisika in vode v reakciji, izraženi z naslednjo kemijsko enačbo:
Tudi2 + 2H2O + 4e- => 4OH-
Medtem ko ioni h+ Se spremenijo v h2:
2H+ + 2e- => H2
To je, oh- in h2 So običajni proizvodi galvanskih ali elektrokemičnih korozij.
Tudi če kovina R ne sodeluje v nobeni reakciji, je dejstvo, da je bolj plemenit, da M spodbuja njegovo oksidacijo; In posledično bo večja proizvodnja OH ionov- O vodikov plin. Ker je navsezadnje razlika med redukcijskimi potenciali, ΔE, eden glavnih motorjev teh procesov.
Železna korozija
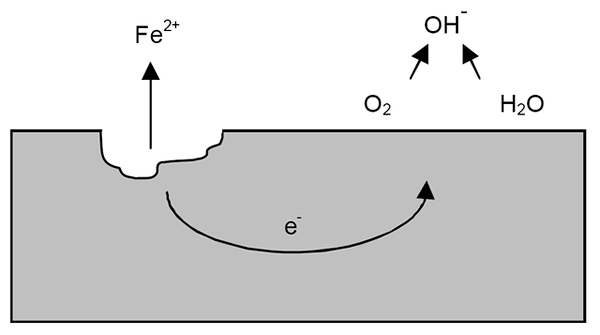 Korozijski mehanizem za železo. Vir: Wikipedia.
Korozijski mehanizem za železo. Vir: Wikipedia. Po predhodnih pojasnilih lahko obravnavamo primer železne korozije (nadrejena slika). Recimo, da obstaja tanka plast vode, v kateri se raztopi kisik. Brez prisotnosti drugih kovin bodo depolarizadorji označeni z reakcijskimi smernicami.
Tako bo železo izgubilo nekaj atomov na svoji površini, da se raztopi v vodi kot vera2+:
Fe => vera2+ + 2e-
Oba elektrona bosta potovala po železnem delu, ker sta dober prevodnik električne energije. Tako da je znano, kje se je začelo oksidacija ali anodno mesto; Toda ne tam, kjer se bo nadaljevalo zmanjšanje ali lokacija katodnega mesta. Katodno mesto je lahko kjer koli; In višja je možno območje, še huje bo korozija kovine.
Recimo, da elektroni dosežejo točko, kot je prikazano na zgornji sliki. Tam trpita tako kisik kot voda že opisana reakcija, s katero se sprosti OH-. Ti anioni oh- Lahko reagirajo z vero2+ Oblikovati vero (OH)2, ki obori in trpi naknadne oksidacije, ki jo končno spremenijo v rje.
Medtem anodno mesto vedno bolj razpoka.
Primeri
V vsakdanjem življenju so primeri galvanskih korozij številni. Ni se nam treba sklicevati na železno krono: kateri koli artefakt iz kovin lahko v prisotnosti mokrih in fizioloških okolj utrpi enak postopek.
Vam lahko služi: fosfatna skupinaPoleg plaže lahko zima prispeva tudi idealne pogoje za korozijo; Na primer, ko vržete soli na cestni sneg, da preprečite drsanje avtomobilov.
S fizičnega vidika lahko v varjenih sindikatih dveh kovin zadrži vlago, saj so aktivna mesta korozije. To je zato, ker se obe kovini obnašata kot dve elektrodi in najbolj reaktivni bodo izgubili svoje elektrone.
Če OH ionska proizvodnja- Je veliko, lahko celo zaženete barvo avtomobila ali zadevni artefakt.
Anodni indeksi
Svoje primere galvanskih korozij lahko sestavite s pomočjo tabel za redukcije potencialnih. Vendar bo za ponazoritev te točke izbrana tabela anodnega indeksa (poenostavljena sama po sebi).
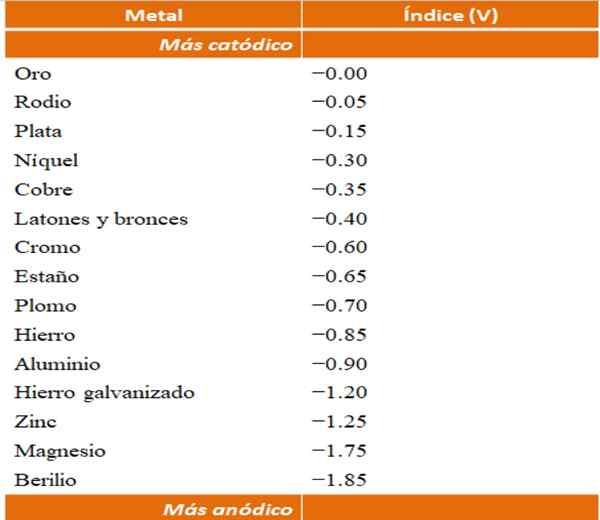 Anodni indeksi za različne kovine ali zlitine. Vir: Wikipedia.
Anodni indeksi za različne kovine ali zlitine. Vir: Wikipedia. Recimo na primer, da bi radi zgradili elektrokemično celico. Kovine, ki so zgornji del tabele anodnih indeksov, so bolj katoda; to pomeni, da se zlahka zmanjšajo in jih bo zato težko imeti v rešitvi. Medtem ko so kovine, ki so na dnu, bolj anodne ali reagente in enostavno tečejo.
Če izberemo zlato in berilij, obe kovini ne bi mogli dolgo časa skupaj, saj bi berilij oksidiral z izjemno hitro.
In če imamo nasprotno, imamo rešitev Ag ion+ In v njej potopimo aluminijasto palico, hkrati pa se raztopi, kar obori kovinske srebrne delce. Če se ta vrstica poveže z grafitno elektrodo, bi elektroni odpotovali nanjo, da bi elektrokemično položili srebro kot srebrni film.
In če namesto aluminijaste palice ni iz bakra, bi raztopina postala modrikasta s prisotnostjo ionov Cu2+ v vodi.
Zaščita pred elektrokemično korozijo
Žrtvene prevleke
Recimo, da je namenjena zaščiti lamine korozije v prisotnosti drugih kovin. Najlažja možnost bi bila dodati magnezij, ki bi pokril cink, tako da, ko oksidirajo, elektroni, sproščeni iz magnezija, zmanjšajo katione Zn2+ nazaj.
Vendar pa bi film MGO o cinku prej kot slej na koncu pokvaril, kar bi zagotovilo trenutno mesto; to pomeni, da bi cinkova korozija na teh točkah močno pospešila.
Ta tehnika zaščite pred elektrokemično korozijo je znana kot uporaba žrtvovanja. Najbolj znan je cink, ki se uporablja v znani tehniki, imenovani galvanizacija. V njih je pokrit kovina M, zlasti železo, cink (vera/Zn).
Vam lahko služi: fenolftalein (C20H14O4)Spet cink oksidira in njegov oksid služi za pokritje železa in oddajanje elektronov, ki zmanjšujejo vero2+ ki je mogoče oblikovati.
Plemenite prevleke
Ponovno predpostavimo, da želite zaščititi isti cinkov list, zdaj pa bo namesto magnezija uporabljen krom. Krom je bolj plemenit (bolj katodni, glej mizo anodnih indeksov) kot cink, zato deluje kot plemenita prevleka.
Težava te vrste prevleke je, da bo, ko bo počila, spodbujala in še pospešila oksidacijo kovine spodaj; V tem primeru je cink še bolj korodiran kot pokrit z magnezijem.
In končno obstajajo tudi drugi prevleki, ki so sestavljeni iz slik, plastike, antioksidantov, maščob, smol itd.
Otroški eksperiment
Železna plošča v bakrenih soli
Preprost eksperiment je mogoče zasnovati iz iste tabele anodnih indeksov. Razpustitev razumne količine (manj kot 10 gramov) CUSO4· 5H2Ali v vodi, otroka prosimo, da se potopi na polirano železno ploščo. Fotografija je posneta in postopek se lahko razvija nekaj tednov.
Raztapljanje je sprva modrikasto, vendar bo začelo izgubljati obarvanost, medtem ko železna plošča pridobiva barvno barvo. To je zato, ker je baker plemenit kot železo, zato so njeni kationi cu2+ Zmanjšali bodo na kovinski baker iz ionov, ki jih dodeljuje oksidacija železa:
Fe => vera2+ + 2e-
Cu2+ + 2e- => Cu
Čiščenje srebrnega oksida
Srebrni predmeti se sčasoma črnijo, še posebej, če so v stiku z virom žveplovih spojin. Njegov oksid je mogoče odstraniti, če je predmet potopljen v vodno kad z natrijevim bikarbonatom in aluminijasto folijo. Bikarbonat zagotavlja elektroliti, ki bodo olajšali transport elektronov med predmetom in aluminijem.
Kot rezultat, otrok lahko ceni, da predmet izgubi črne lise in bo sijal s svojo značilno srebrno barvo; Medtem ko bo aluminijasta folija potekala, dokler ne izgine.
Reference
- Shiver & Atkins. (2008). Anorganska kemija. (Četrta izdaja). MC Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Wikipedija. (2019). Galvanska korozija. Pridobljeno iz: v.Wikipedija.org
- Stephen nižji. (16. junij 2019). Elektokemična korozija. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Odprta univerza. (2018). 2.4 Korozijski postopek: galvanska korozija. Okrevano od: Open.Edu
- Stranka Tehnična servisna krtača Wellman Inc. (s.F.). Vodnik po galvanski koroziji. Brush Wellman inženirski materiali.
- Giorgio Carboni. (1998). Poskusi v elektrokemiji. Pridobljeno iz: Fensci.com
- « Izvor sofističnega relativizma, značilnosti, primeri
- Ciklična struktura ogljikovodikov, lastnosti, primeri »

