Ciklična struktura ogljikovodikov, lastnosti, primeri
- 4938
- 742
- Ms. Pablo Lebsack
The Ciklični ogljikovodiki So organske spojine, sestavljene iz atomov ogljika in vodika, ki so povezani z obroče ali cikličnimi strukturami. V glavnem obstajajo tri vrste: Alikomija, aromatična in policiklična.
Te vrste ogljikovodikov lahko nato sestavljajo zaprte različice alkanov, alkenov in alkinov; imajo obroče z aromatičnimi sistemi, kot so benzen in njegovi derivati; ali predstavljajo zapletene in očarljive strukture. Od vseh so Alicikliki najpreprostejši in so običajno predstavljeni z uporabo poligonov.
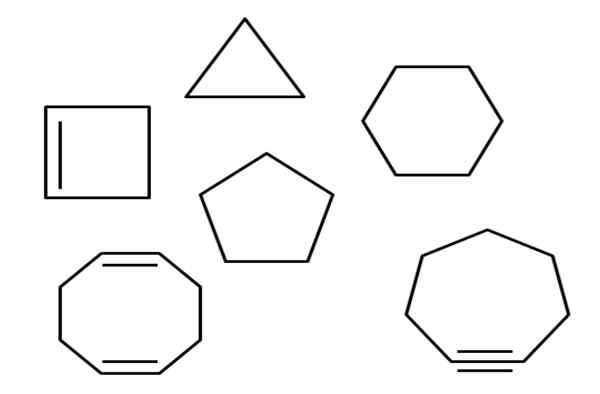
 Aliciklični ogljikovodiki. Vir: Gabriel Bolívar.
Aliciklični ogljikovodiki. Vir: Gabriel Bolívar. Na primer, na primer je več alicikličnih ogljikovodikov. Zdi se preprosti poligoni: kvadrat, trikotnik, pentagon, šesterokotni itd. Če bi bilo mogoče eno od njegovih C-C povezav razrezati s škarjami, bi bil rezultat alkan, alkene (če ima dvojne povezave) ali Alquino (če imate povezave Triples).
Njegove lastnosti se ne razlikujejo preveč od ogljikovodikov z odprtimi verigami, iz katerih nadaljujejo; Čeprav je kemično, večji, bolj stabilni bodo, in njegova interakcija z molekularnim medijem postane najbolj izrazita (za svoje največje kontaktno območje).
[TOC]
Struktura
Če gredo naravnost na zadevo, ki zadeva njihove strukture, je treba razjasniti, da te niso ravno, tudi če se v predstavitvi poligonov zdijo tako. Edina izjema od te trditve najdemo v ciklopropanu.
Prav tako je treba pojasniti, da sta izraza "cikli" in "obroči" pogosto zamenljiva; Obroč ni treba krožiti in zato lahko pridobi neskončne geometrije, dokler je zaprta struktura. Nato rečemo, da ima ciklopropan obroč ali trikotni cikel.
Vsi ogljikovi hibridizaciji imajo SP3, Tako so njihove geometrije tetraedrale in njihove povezave morajo biti idealno ločene s kotom 109,5 °; Vendar to ni mogoče za strukture tako zaprte kot strukture ciklobutana (kvadrat) ali ciklopentano (Pentagon).
Lahko vam služi: benzimidazol (C7H6N2): Zgodovina, struktura, prednosti, slabostiNato se govori o napetosti, ki destabilizira molekulo, in se eksperimentalno določi z merjenjem povprečnih ogrevanja zgorevanja vsake skupine2.
Skladnosti
In kaj se zgodi, ko obstajajo dvojne ali trojne povezave? Napetost se poveča, ker tam, kjer je eden od njih, bo struktura prisiljena "skrčiti" in ostati ravno; ki bi, zaporedno, prisilila konformacijo nad drugimi, verjetno zasenči sosednje atome vodika.
 Konformi za cikloheksan. Vir: Sponk [javna domena]
Konformi za cikloheksan. Vir: Sponk [javna domena] Na zgornji sliki sta prikazani dve konferenci za cikloheksan, ki poskušata razložiti zgoraj navedeno. Atomi, ki so v položajih do tudi in Pravijo, da so osni oziroma ekvatorialni. Upoštevajte, da imate namesto ravnega šesterokotnega stola (levo) in čoln (desno).
Te strukture so dinamične in vzpostavljajo ravnovesje med njimi. Če atomi v do So zelo zajetni, prstan jih bo "spreminjal", da jih bo postavil v ekvatorialne položaje; Ker so tam usmerjeni proti straneh obroča (ki bi okrepili ali škodovali medmolekularnim interakcijam).
Če vsak ogljik opazimo ločeno, bo razvidno, da so tetraedrali. To ne bi bilo tako, če bi obstajala dvojna vez: njegove hibridizacije SP2 Strukturo bi prisilili, da se splošči; in imeti trojno povezavo, do poravnave. Ravna struktura benzena je največja predstavitev tega.
Lastnosti
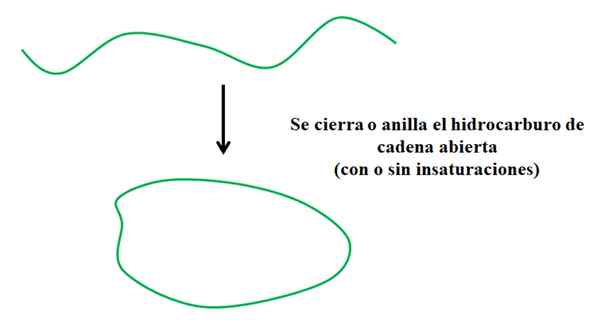 Poenostavljen postopek, v katerem nastane ciklični ogljikovodik. Vir: Gabriel Bolívar.
Poenostavljen postopek, v katerem nastane ciklični ogljikovodik. Vir: Gabriel Bolívar. Recimo, da imate ogljikovodik z odprtimi verigami (z nenasičenostjo ali posledicami ali brez njih). Če bi se lahko pridružili njihovim koncem, bi nastal prstan ali cikel (na primer na zgornji sliki).
Iz optike organske sinteze se to ne zgodi več; Obstajajo dobre odhodne skupine, povezane na koncih verige, ki ob odhodu promovirajo, da se veriga zapre (če je rešitev zelo razredčena).
Vam lahko služi: Heptano (C7H16): struktura, lastnosti in uporabeGlede na to je razvidno, da ogljikovodik Green Stroke trpi le za preobrazbo glede na njegovo strukturo; Brez preloma ali dodajanja novih povezav z drugimi atomi. To pomeni, da je kemično še naprej enak pred in po zaprtju ali zvonjenju.
Zato se kemične ali fizikalne lastnosti teh allicil ogljikovodikov ne razlikujejo preveč od lastnosti njihovih odprtih verig. Oba sta reagenta iste vrste (če rečem, halogeni pod utravioletno svetlobo) in lahko z sproščanjem utrpijo močne oksidacije ali zgorevanje.
Medmolekularne sile
Obstaja nesporno dejstvo: obroč ima večje območje stika kot odprta veriga, zato so njegove medmolekularne interakcije močnejše.
Rezultat tega je, da so njegove vrele in fuzijske točke ponavadi večje, tako kot njihove gostote. Veliko toliko razlik je mogoče opaziti v njihovih stopnjah refrakcije ali parnim tlakom.
Nomenklatura
Ko se vrne na primer ogljikovodika zelene kapi, njegova nomenklatura ostane nespremenjena, ko se zapre na sebi (kot kača, ki ugrizne svoj rep). Zato pravila nomenklature ostajajo enaka; razen če se ne obravnavajo policiklični ali aromatični ogljikovodiki.
Spodaj so prikazane tri spojine, ki bodo dobile ustrezna imena:
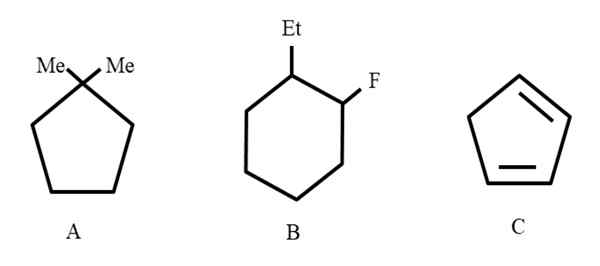 Trije primeri cikličnih ogljikovodikov, da dodelijo svoje nomenklature. Vir: Gabriel Bolívar.
Trije primeri cikličnih ogljikovodikov, da dodelijo svoje nomenklature. Vir: Gabriel Bolívar. Za začetek, ko so zaprte strukture, se zanje uporabi prefiksni cikel (tukaj je besedni obroč ponovno).
Od leve proti desni imamo: ciklopentano, cikloheksan in še en ciklopentano. Carboni so navedeni tako, da so manjše številke dodeljene nadomestkom, omenjene pa so tudi po abecednem vrstnem redu.
Vam lahko služi: Renio: odkritje, lastnosti, struktura, uporabeTako postane: 1,1-dimetilciklopentano. V B se začne z omembo etilnega substituenta pred fluorom, tako da je ime: 1-etil-2-fluorcicloheksano. In nato za C, dvojne vezi jemljejo kot substituente, število ogljikov, ki jih tvorijo, mora biti navedeno: 1,3-ciklopentadieno.
Primeri
Več cikličnih ogljikovodikov je v celotnem članku omenilo več cikličnih. Na prvi sliki jih lahko najdemo: cikloopropan, ciklobutan, ciklopentano, cikloheksan, cikloheptan in cikloktan.
Iz njih je mogoče dobiti široko paleto derivatov in dovolj je, da postavite dvojne ali trojne povezave, da imajo cikloalkete oziroma cikloalkvine. In glede na aromatične ogljikovodike je dovolj, da upoštevamo benzenski obroč in ga nadomestite ali reproducirate v dveh dimenzijah.
Vendar so najbolj izredni (in problematični pri razumevanju njihove nomenklature) policiklični ogljikovodiki; Se pravi, da s preprostimi poligoni ni dovolj, da bi jih na preprost način predstavljali. Tri, ki jih je treba omeniti, so: Kuban, košara in pagodano (nižje slike).
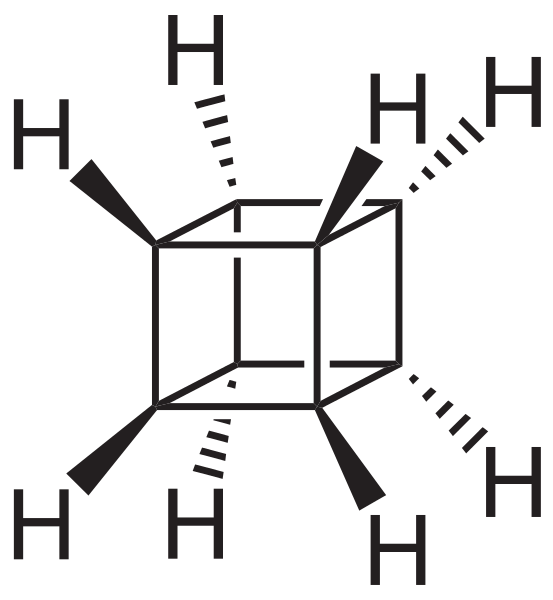 Kubanski okostje. Vir: Neurotoger [javna domena].
Kubanski okostje. Vir: Neurotoger [javna domena].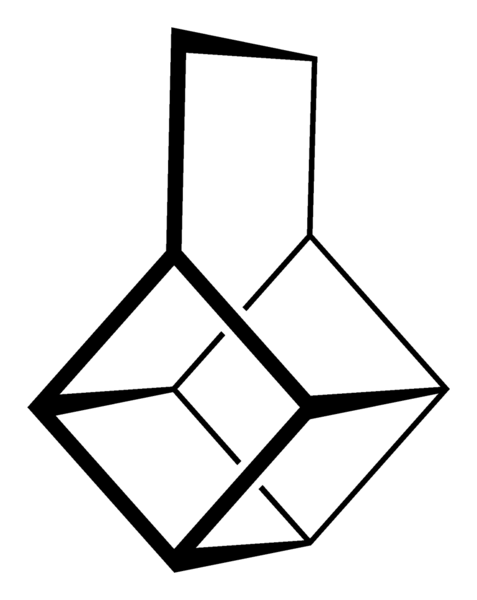 Skelet Canastano. Vir: Benjah-BMM27 [javna domena].
Skelet Canastano. Vir: Benjah-BMM27 [javna domena]. Pagodano okostje. Vir: Puppy8800 [javna domena]
Pagodano okostje. Vir: Puppy8800 [javna domena]
Vsak od njih ima svojo kompleksno metodologijo sinteze, svojo zgodovino, umetnost in latentno fascinacijo z neskončnimi strukturnimi možnostmi, do katerih lahko dosežejo preprosti ogljikovodiki.
Reference
- Morrison, r. T. in Boyd, r, n. (1987). Organska kemija. 5. izdaja. Uredništvo Addison-Wesley Interamerican.
- Carey f. (2008). Organska kemija. (Šesta izdaja). MC Graw Hill.
- Graham Solomons t.W., Craig b. Fryhle. (2011). Organska kemija. Amine. (10. izdaja.). Wiley Plus.
- Reid Danielle. (2019). Ciklični ogljikovodiki: definicija in primer. Študij. Okrevano od: študij.com
- Fundacija CK-12. (5. junij 2019). Ciklični ogljikovodiki. Kemija librettexts. Okrevano od: kem.Librettexts.org
- Wikipedija. (2019). Ciklična spojina. Pridobljeno iz: v.Wikipedija.org
- Miguel Cowboy. (2019). Ciklični ogljikovodiki. Okrevano od: decias.mreža
- « Mehanizmi galvanske korozije, primeri, zaščita
- Zgodovina, značilnosti in pomen totipotencialnosti »

