Kemična spojina
- 2880
- 866
- Miguel Gutmann DVM
Pojasnjujemo, katere kemične spojine so sestavljene, vrste, ki obstajajo, razlike s kemičnimi elementi in dajejo več primerov.
 Kemične spojine so vse tiste snovi, ki ima atome dveh različnih kemičnih elementov
Kemične spojine so vse tiste snovi, ki ima atome dveh različnih kemičnih elementov Kaj je kemična spojina?
A Kemična spojina To je snov, ki jo tvori zveza dveh ali več atomov različnih kemičnih elementov. Kemične spojine ostajajo združene zaradi kemičnih vezi, ki so povezane z elektroni povezanih atomov; to pomeni, da v kemični spojini (zunanji) elektroni atomov posegajo v tvorbo povezav.
Komponente kemijskih spojin (kemičnih elementov) ni mogoče ločiti med fizikalnimi metodami, kot so: destilacija, centrifugiranje, filtracija itd., zahtevajo kemične metode, da ga dosežejo.
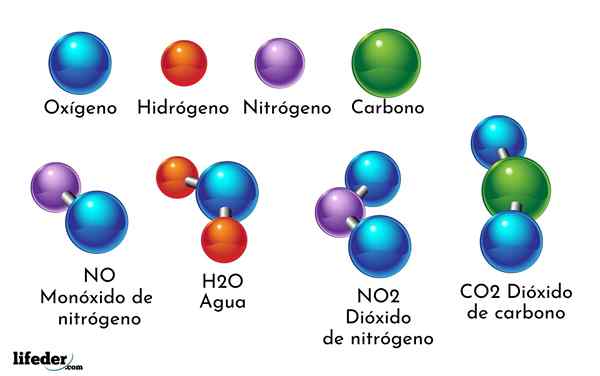
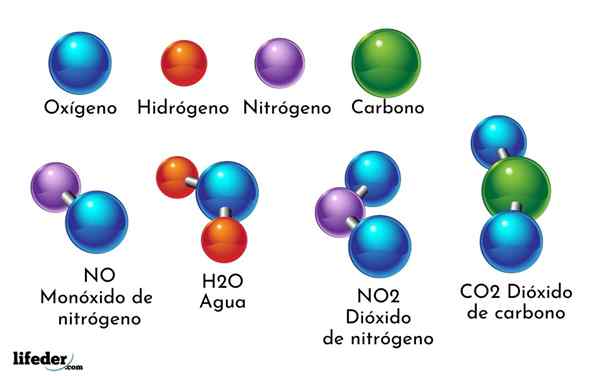
Primer kemične spojine je voda. Nastajata le dva atoma dveh različnih kemičnih elementov: kisik in vodik, ki ima kemijsko formulo H2Tudi. Zato se dva h vežeta z eno ali tvorita h2Tudi.
Kemični element, za razliko od kemičnih spojin, je najpreprostejši in najosnovnejši način, ki predstavlja materijo. Predstavljen je kot edinstvena vrsta atoma, ki ga s kemičnimi reakcijami ni mogoče razčleniti na enostavnejše snovi.
Vrste kemičnih spojin
Kemične spojine je mogoče razvrstiti predvsem po dveh meril:
- Glede na vrsto vezi, ki združuje kemične elemente v kemični spojini.
- Glede na sestavo in strukturo kemične spojine.
Glede na vrsto povezave
Odvisno od vrste povezave so lahko kemične spojine:
- Molekule. Gre za kemične spojine, ki jih tvorita dve ali več vrst različnih kemičnih elementov, ki se jim pridruži kovalentna vez. Za to povezavo je značilna skupna raba enega ali več parov zunanjih elektronov ali Valencije med dvema atomama.
- Ioni. Električno obremenjene kemične spojine se imenujejo ionske kemijske spojine, njihove ione pa združujejo Ionska povezava. Ta vez se pojavi pri združevanju kemičnega elementa tipa kovine z nemetalnim kemičnim elementom.
- Intermetalne spojine. To je vrsta kovinske zlitine, ki predstavlja trden material, ki je med dvema ali več kovinskimi kemičnimi elementi, da jih ohranjata skupaj.
- Koordinacija. Oblikovajo jih osrednji kovinski element, imenovan koordinacijski center, in obkroža nabor združenih molekul ali ionov, znanih kot ligandi. Hemoglobin je na primer protein, ki ga najdemo v rdečih krvnih celicah in ki v krvi prevaža kisik. Hemoglobin ima koordinacijsko spojino, imenovano Grupo Hemo. V središču hemo je železni atom, ki posega v transport kisika skozi hemoglobin.
Glede na sestavo in strukturo
V skladu s tem merilom so kemijske spojine razvrščene kot organske in anorganske.
- Organske spojine. So spojine, katerih glavni kemični element je ogljik, ki običajno tvorijo povezave z atomi istega ogljika in vodika. Vendar pa so prisotni tudi, čeprav v manjši meri kisik, dušik, žveplo, boran, fosfor itd. Organske spojine so lahko:
- Alifatski. Molekule alifatskih spojin imajo lahko linearne ali ciklične oblike, torej v zaprtih oblikah, kot so trikotniki, kvadratki, pentagoni itd. Imajo lahko ogljikove vezi treh vrst: preproste (c-c), dvojne (c = c) ali trojno (c≡C).
- Aromatična. So ciklične spojine, ki izmenično predstavljajo preproste vezi ogljikovega ogljika in dvojne ogljikove ogljikove vezi.
- Heterociklični. So spojine, ki imajo ciklično strukturo, ki lahko predstavlja zamenjavo ogljikovega atoma z drugim kemičnim elementom (o, s, n itd.).
- Organometalno. So organske spojine, ki se lahko predstavljajo v kovinskih elementih sestave.
- Polimeri. Gre za velike molekule (makromolekule), ki jih tvorijo majhne in enake enote, ki se ponavljajo po celotnem polimeru, in ki se imenujejo monomerije.
- Anorganske spojine. Anorganske spojine, za razliko od organskih. Anorganske spojine so lahko:
- Osnovni oksidi. Nastajajo z reakcijo kovinskega kemičnega elementa, kot so natrij, kalcij, železo, baker itd., S kisikom. Na primer, natrijev oksid (NAO) je osnovni oksid. Imenujejo jih osnovni oksidi, ker bodo povzročili baze ali hidrokside.
- Kisli oksidi. Izvirajo z reakcijo nemetalnega kemičnega elementa, kot so klor, fluor, žveplo, bromin itd., S kisikom. Na primer bromski oksid (Br2Tudi5) To je kisli oksid. Imenujejo jih kisli oksidi, ker povzročajo kisline.
- Hidrorji. V svoji kemični sestavi predstavljajo prisotnost vodika. Obstajata dve vrsti: kovinski hidros in ne -metalni hidrorji.
- Kovina. Nastajajo z reakcijo vodika z oksidacijskim stanjem -1, s kovino. Te kemične spojine so edine, v katerih je vodik prisoten z oksidacijskim stanjem -1. Na primer Cah2 To je kalcijev hidrid.
- Ne kovinsko. Nastajajo z reakcijo vodika, z oksidacijskim stanjem + 1, z nemetalnim elementom z nižjo oksidacijsko stanje. Klorin hidrid (HCl) je plin, ki se pri raztopitvi klorovodikove kisline v vodi.
- Kisline. So anorganske kemične spojine, čeprav obstajajo organske kisline, ki imajo pH manj kot 7 in se obrnejo na barvo rdečega papirja do rdečega. Lahko jih razvrstimo v hidracide in oksacide.
- Hidracy. Izvirajo iz reakcije vodika z ne -metalom, da tvorijo hidrid, ki se raztopi v vodi, izvira iz kisline; Na primer iarhidrična kislina (HI).
- Oxcacidi. Izvira iz reakcije oksida nemetalnega kemičnega elementa z vodo. Na primer reakcija žveplovega oksida (tako3) Z vodo proizvaja žveplovo kislino (h2SW4).
- Greš ven. So kemične spojine, ki izvirajo z interakcijo kisline in osnovnih spojin. V svoji sestavi je lahko toliko kovinskih elementov kot ne -metalni. Soli so razvrščene kot:
- Nevtralne soli. Izvirajo v reakciji nevtralizacije med kislino in bazo s tvorbo soli in vode. Na primer, natrijeva hidroksidna reakcija (NaOH) s klorovodikovo kislino (HCl) proizvaja natrijev klorid (NaCl), sol in vodo. Imenujejo se nevtralne, ker ne proizvajajo variacije pH.
- Kisle soli. Nastajajo z reakcijo kovinskega hidroksida z Valencijo +1, z kislino z več vodiki. Reakcija litijevega hidroksida (LIOH) z ogljikovo kislino (H2Co3), ustvari zamenjavo samo enega vodika z litijem, kar povzroči bikarbonat litija (Lihco3), Kisla sol in voda.
- Osnovne soli. Nastajajo z reakcijo baze, ki ima več kot eno skupino OH s hidratno kislino, na primer klorovodikovo kislino. Ko reagirate s kislino s kalcijevim hidroksidom, CA (OH)2, Atom klora nadomešča hidroksilno skupino (OH). To proizvaja kalcijev hidroksiklorid (cuckoh), osnovno sol in vodo.
Razlike med kemičnimi spojinami in kemičnimi elementi
 Navzgor po kemičnih elementih in kemičnih spojinah. Kemične spojine tvorijo zgornji elementi
Navzgor po kemičnih elementih in kemičnih spojinah. Kemične spojine tvorijo zgornji elementi Vsak kemični element ustreza določenemu atomu in samo s to vrsto atoma; to pomeni, da kemični element nima različnih vrst atomov. Atom je osnovni delček snovi, ki ni razdeljen s fizikalnimi ali kemičnimi metodami.
Atom kemičnega elementa se lahko združi z atomi drugih kemičnih elementov, da tvori kemične spojine, ki jih lahko ločimo na njihove komponente (kemične elemente) z uporabo kemijskih metod.
Kemični elementi in kemične spojine z uganko so lahko opremljeni: koščki sestavljanke imajo različne lastnosti, tako da se lahko ujemajo s kemičnimi elementi.
Koščki sestavljanke se lahko pridružijo, da tvorijo različne figure. Oblikovane številke je mogoče enačiti s kemičnimi spojinami. Ko je dejavnost končana, lahko številke sestavljanke ločimo na koščke, ki jo predstavljajo.
Primeri kemijskih spojin
Spodaj si lahko ogledate vrsto primerov dnevnih kemičnih spojin:
- HCl: klorovodikova kislina
- H2S: sulfhidrična kislina
- HF: fluorhidrična kislina
- H2SW4: Žveplova kislina
- Hclo4: Perklorna kislina
- H3Po4: Fosforna kislina
- H2Co3: Ogljikova kislina
- Hno3: Dušikova kislina
- Naoh: natrijev hidroksid
- CA (OH)2: Kalcijev hidroksid
- Vera (OH)2: Železov hidroksid
- Vera (OH)3: Železov hidroksid
- Ne: natrijev hidrid
- Cu2O: Cuprous oksid
- CUO: CuPric Oxid
- Vera2Tudi3: Železov oksid
- Cl2Tudi7: Perklorični oksid
- Br2O: hipobromski oksid
- Yo2Tudi3: Hipoalodozni oksid
- NaCl: natrijev klorid
- FECL3: Železov klorid
- HCO3: Natrijev bikarbonat
- Pogl3Pot: natrijev acetat
- Na2SW4: Natrijev sulfat
- Feso4: Železov sulfid
- H2O: Voda
- Co2: Ogljikov dioksid
- C6H12Tudi6: Glukoza
- C12H22Tudienajst: Saharoza
Druge zanimive teme
Kemične reakcije
Kemija v vsakdanjem življenju: primeri
Organske spojine
Anorganske spojine
Kemična vez
Čiste snovi
Reference
- Whitten, Davis, Peck & Stanley. (2008). Kemija. (8. izd.). Cengage učenje.
- Wikipedija. (2021). Kemična spojina. Pridobljeno iz: v.Wikipedija.org
- Čelada, Anne Marie, ph.D. (27. avgust 2020). Sestavljena opredelitev v kemiji. Okreval od: Thoughtco.com
- Toppr. (s.F.). Kaj je spojina v kemiji? Vrste kemične spojine. Okrevano od: toppr.com

