Struktura železnega klorida (III), lastnosti, pridobivanje, uporabe
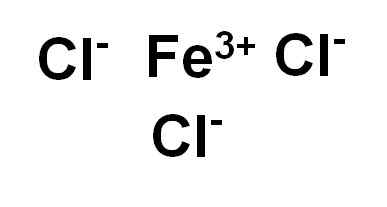
- 1659
- 463
- Ignacio Barrows
On železni klorid (iii) Gre. Njegova kemična formula je FECL3. Je kristalna trdna snov, katere barva je lahko od oranžne do črno rjave barve.
Fecl3 Z lahkoto se raztopi v kislih vodnih raztopinah, v katerih je s povečanjem pH bolj alkalne.
 Železni klorid (III) ali Ferric klorid FECL3 trden. Egor osin/cc by-sa (https: // creativeCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons.
Železni klorid (III) ali Ferric klorid FECL3 trden. Egor osin/cc by-sa (https: // creativeCommons.Org/licence/by-sa/3.0. Vir: Wikimedia Commons. Železni klorid (III) se uporablja za uvedbo delcev, ki onesnažujejo komunalno ali industrijsko odpadno vodo. Govori se, da vam omogoča, da odstranite nekaj zajedavcev in služijo zaustavitvi izgub krvi pri živalih pri živalih in za celjenje le -teh.
Služi za pridobivanje bakra (II) bakrenih sulfidnih mineralov. Uporablja se tudi v različnih kemičnih reakcijah in analizi bioloških in kemičnih laboratorijev. Na primer, služi za odkrivanje spojin kot fenolov v oljih, pridobljenih iz rastlin. Uporablja se v elektronskih vezjih, v usnjenem tiru in v fotografiji.
Ker je FECL3 Kislinska spojina je jedka za kožne in sluznice. Prah te spojine se je treba izogniti. Ne sme se zavreči v okolje.
[TOC]
Struktura
Železni klorid (III) ali Ferric klorid FECL3 Je ionska spojina in jo tvori železova vera3+ in tri ione kloride Cl-. Železo je v svojem oksidacijskem stanju +3 in vsak klor ima Valencia -1.
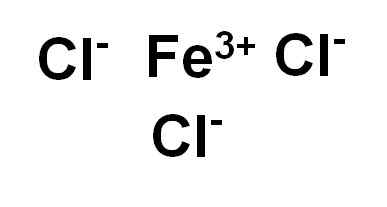 Železni klorid (iii) ali železov klorid. Avtor: Marilú Stea.
Železni klorid (iii) ali železov klorid. Avtor: Marilú Stea. Nomenklatura
- Železni klorid (iii)
- Železni klorid
- Železni triklorid
- Železno muraaturo
Lastnosti
Fizično stanje
Kristalno trdna oranžna do črno rjava.
 Ferrični klorid Fecl3 brezvodna (brez vode). Leiem/cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons.
Ferrični klorid Fecl3 brezvodna (brez vode). Leiem/cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons. Molekularna teža
Anhidro fecl3 = 162,2 g/mol
Tališče
Anhidro fecl3 = 304 ° C
Heksahidrat Fecl3 •6H2O = 37 ° C
Vrelišče
Anhidro fecl3 = Približno 316 ° C
Heksahidrat Fecl3 •6H2O = 280-285 ° C
Gostota
Anhidro fecl3 = 2,90 g/cm3 pri 25 ° C
Topnost
Zelo topno v vodi: 74,4 g/100 g vode pri 0 ° C; 535,7 g/100 g vode pri 100 ° C. Zelo topno v acetonu, etanolu, etru in metanolu. Šibko topno v ne -polarnih topilih, kot sta benzen in heksan.
Vam lahko služi: boron: zgodovina, lastnosti, struktura, uporabeph
Njegove vodne raztopine so zelo kisle. Raztopina 0,1 mola FECL3 na liter vode ima pH 2,0.
Kemične lastnosti
Ko se fadl raztopi v vodi3 Je hidrolizirana; to pomeni, da se ločuje v svojih verah3+ in 3 Cl-. Vera3+ tvorijo hexaacuohierro ion [vera (h2Da)6]3+ Toda to je kombinirano z OH ioni- mešanih vrst, ki tvorijo vodo in sproščajo protone h+.
Zaradi tega so njihove rešitve kisle. Če pH narašča, te vrste tvorijo gel in na koncu nastane oborina ali trdna snov hidrirane vere železovega oksida2Tudi3 •Nh2Tudi.
Kristali železovega klorida (III) so higroskopski, to je, da absorbirajo vodo iz okolja. Ko je moker, je jedko za aluminij in številne kovine.
 Rešitve FECL3 Lahko so zelo kisle in jedke, ker vsebujejo HCl. Kanesskong/cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons.
Rešitve FECL3 Lahko so zelo kisle in jedke, ker vsebujejo HCl. Kanesskong/cc by-sa (https: // creativeCommons.Org/licence/by-sa/4.0. Vir: Wikimedia Commons. Vodne rešitve FECL3 So zelo kisle in jedke za večino kovin. Imajo šibek vonj po klorovodiki HCl. Ko se FECL segreje do njegovega razpada3 oddaja visoko strupene HCl pline.
Pridobivanje
Železni klorid (III) nastane z neposrednim kloriranjem železa z reakcijo suhega klora (CL2) Z železnimi ostanki (vera) pri 500-700 ° C.
Reakcija se izvaja v kislinskem reaktorju. Prvi korak je, da se pri 600 ° C stopi z mešanico železnega klorida (III) (FECL3) in kalijev klorid (KCL).
 Fecl3 Pripraviti ga je treba v posodah, zelo odpornih na kisline, kot je nerjavno jeklo. Avtor: Johannes Plenio. Vir: Pixabay.
Fecl3 Pripraviti ga je treba v posodah, zelo odpornih na kisline, kot je nerjavno jeklo. Avtor: Johannes Plenio. Vir: Pixabay. Potem se železni ostanki (vera) raztopijo v tisti staljeni mešanici, kjer železo reagira s FECL3 In postane železov klorid (FECL2).
Fe + 2 FECL3 → 3 FECL2
Potem FECL2 reagira s klorovim CL2 tvori fecl3 ki se sublimira (prehaja od trdnega stanja v plinasto) in se zbira v posebnih kondenzacijskih komorah.
2 FECL2 + Cl2 → 2 FECL3
Lahko tudi reagirate železov feso sulfat4 s klorom CL2.
Heksahidrat Fecl3 •6H2O ga lahko dobimo z izhlapevanjem vodne raztopine verodostojnih ionov3+ in Cl- V parni kopeli.
Vam lahko služi: kvartarne spojine: značilnosti, usposabljanje, primeriPrisotnost v naravi
Železni klorid ali železov klorid (III) najdemo v obliki v obliki minerala MO -minerala, ki ga najdemo v lavi aktivnih vulkanskih fumarolov. Med vulkani, kjer lahko najdete, je Mount Vesubio.
 Fecl3 Je del moysite rude, ki je v aktivnih vulkanih. Avtor: Skeze. Vir: Pixabay.
Fecl3 Je del moysite rude, ki je v aktivnih vulkanih. Avtor: Skeze. Vir: Pixabay. Prijave
Pri čiščenju odpadne vode
Železni klorid se uporablja za zdravljenje komunalne ali industrijske odpadne vode.
Deluje kot koagulant, ki daje prednost združitvi več delcev drug z drugim, na ta način se oblikujejo konglomerati ali večji delci, ki se ponašajo z flokkularnim ali usedlinam (spuščanje lastne teže na dno vode, ki se zdravi).
 Fecl3 Uporablja se za ločevanje nezaželenih materialov od voda, ki jih zavržejo skupnosti ali panoge. Avtor: 后园 卓 卓. Vir: Pixabay.
Fecl3 Uporablja se za ločevanje nezaželenih materialov od voda, ki jih zavržejo skupnosti ali panoge. Avtor: 后园 卓 卓. Vir: Pixabay. Na ta način je naklonjeno ločitvi vodnih trdnih snovi in to je brez neželenih materialov.
Ta vrsta zdravljenja lahko olajša odstranjevanje parazitov, kot so protozoji, ki so mikroorganizmi, ki jih tvori ena celica, kot je Amibas, ki povzročajo bolezen.
Zaradi tega FECL3 Uporablja se tudi za čiščenje vode.
V postopkih veterinarskega zdravljenja
Železni klorid (III) se uporablja za zdravljenje poškodb živali.
Služi kot lokalni adstrigent (lahko umaknete tkiva in deluje kot protivnetno in zdravilno) in hemostatično (ustavi krvavitev ali izgube krvi).
Uporablja se v prahu za zaustavitev izgube krvi ali ko so konji rezani za govedo. Uporablja se tudi v raztopini za zaustavitev krvavitve, ko se odcepijo kremplji ali bradavice.
 Fecl3 Uporablja se v prahu, ki se nanesejo na krave rezane roge in se izogibajo okužbam. Avtor: Jaclou DL. Vir: Pixabay.
Fecl3 Uporablja se v prahu, ki se nanesejo na krave rezane roge in se izogibajo okužbam. Avtor: Jaclou DL. Vir: Pixabay. Uporablja se tudi za zdravljenje faringitisa (vnetja farinksa) ali stomatitisa (vnetje peroralne sluznice) in za povečanje krvnega hemoglobina pri nekaterih pticah.
Pri ekstrakciji kovin
Železni klorid (III) ali Ferric klorid FECL3 Uporablja se za ekstrakcijo bakra (II) bakrene rude, ki vsebuje sulfide omenjene kovine.
Vam lahko služi: hidroksidiTo je oksidativna metoda, ki je primerna, da se izognete sproščanju strupenega plinskega žveplovega dioksida (tako2), ker namesto tega nastane žveplo (-e). Proizvedene so raztopine z visoko koncentracijo FECL2, FECL3, Cucl2 in drugi kovinski kloridi.
4 FECL3 + Cu2S ⇔ 4 FECL2 + 2 cucl2 + S ↓
Kot reagent kemijskih in bioloških laboratorijev
Med številnimi uporaba kemije služi za označevanje prisotnosti fenolne skupine (to je skupina -OH, pritrjena na benzenski obroč).
Spojina se raztopi, da jo analiziramo v etanolu in dodamo nekaj kapljic raztopine FECL3. Ko ima spojina skupino -oh, pritrjena na benzenski obroč (to je fenol), se tvori modrikasto zeleno obarvanost.
Ta test omogoča analizo prisotnosti fenolov v izvlečkih rastlin.
 Fecl3 V prisotnosti fenolov daje modrikasto zeleno obarvanost. Avtor: Ewa Urban. Vir: Pixabay.
Fecl3 V prisotnosti fenolov daje modrikasto zeleno obarvanost. Avtor: Ewa Urban. Vir: Pixabay. Uporablja se tudi pri preskusih za določitev antioksidantne aktivnosti nekaterih olj, pridobljenih iz zelenjave.
Druga od njenih aplikacij je, da omogoča pripravo drugih kemičnih spojin. Lahko deluje tudi kot oksidacijsko, klorirajoč sredstvo (zagotavlja klor) in kondenzator (da se med seboj pridružite dve ali več molekul).
Služi tudi kot katalizator ali pospeševalnik reakcij organske kemije.
V več aplikacijah
Železni klorid se uporablja v tiskanih elektronskih vezjih. Z obarvanostjo različnih hidriranih oblik služi kot pigment in se uporablja v usnjenem uslužbencu.
 Fecl3 Uporablja se v usnjenem stroju. Avtor: Pexels. Vir: Pixabay.
Fecl3 Uporablja se v usnjenem stroju. Avtor: Pexels. Vir: Pixabay. Je razkužilo. Uporablja se za zdravljenje kožnih motenj in se uporablja tudi pri fotografiji.
Tveganja
Fecl v prahu3 Draži za oči, nos in usta. Če vdih lahko povzroči kašelj ali težko dihanje. To je jedko spojino, zato lahko dolgotrajni stik s kožo in z očmi ali sluznici lahko povzroči rdečico in opekline.
Ni vnetljivo, toda ko segreva pri visokih temperaturah, proizvede HCl vodikov klorid, ki je strupen in zelo jedko.
Fecl3 Škoduje vodnim in kopenskim organizmom. Če ga po naključju zavržemo v okolje, je treba njegovo kislost z osnovnimi spojinami nevtralizirati.
Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Železni klorid. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Kirk-Othmer (1994). Enciklopedija kemijske tehnologije. Zvezek 19. Četrta izdaja. John Wiley & Sons.
- Ullmannova enciklopedija industrijske kemije. (1990). Peta izdaja. Zvezek A22. VCH Verlagsgellschaft MBH.
- Ngameni, b. et al. (2013). Flavonoidi in sorodne spojine iz afriških zdravilnih rastlin. Karakterizacija flavonoidov v rastlinskih izvlečkih. Test železovega klorida. V raziskavah zdravilnih rastlin v Afriki. Okrevano od Scientirect.com.
- Agyare, c. et al. (2017). Petroselinum crispum: pregled. Aktivnost antioksidantov. V zdravilnih špartah in zelenjavi iz Afrike. Okrevano od Scientirect.com.
- Stott, r. (2003). Usoda in obnašanje parazitov v sistemih za čiščenje odpadne vode. Kemično podprta usedlina. V priročniku mikrobiologije vode in odpadne vode. Okrevano od Scientirect.com.
- Tasker, str.Do. et al. (2003). Uporaba koordinacijske kemije. Ekstrakcija CuIi Iz kloridnih rešitev. Pri razumevanju koordinacijske kemije. Okrevano od Scientirect.com.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- « +125 kratke in priljubljene izreke [s pomenom]
- 95 izrekov in rečeno Venezuelanci in njihov pomen »

