Struktura natrijevega cianida (NACN), lastnosti, tveganja, uporabe

- 1263
- 375
- Ignacio Barrows
On Natrijev cianid Gre za anorgansko sol, ki jo tvori natrijev na kation+ in cianid anion cn-. Njegova kemična formula je NACN. Znan tudi kot natrijev cianid, je bela kristalna trdna. Je higroskopska, to je, da absorbira vodo iz okolja, njeni kristali pa so kubični, kot je natrijev klorid.
Ko se raztaplja v vodi, nagiba HCN vodikov cianid. Njegove rešitve zlahka raztopijo zlato in srebro. Zaradi te funkcije je bilo mogoče pridobiti zlato in srebro iz svojih mineralov. Rešitve, uporabljene v ta namen, so reciklirane, to je, da jih večkrat ponovno uporabijo.
 Natrijev natrijev natrijev cianid. L26 [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons.
Natrijev natrijev natrijev cianid. L26 [CC BY-SA 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons. Vendar se nekateri cianid uspe izogniti določenim odpadnim ribnikom, kar predstavlja nevarnost za favno in človeško bitje, ker je cianid zelo strupen in lahko povzroči smrt.
NACN se v kemični industriji uporablja kot posrednik za pripravo več vrst spojin, kot so barvila, kemikalije za kmetijstvo in zdravila ali zdravila.
Natrijev cianid je zelo nevarna spojina, ker lahko povzroči smrt, zato ga je treba manipulirati z izjemno previdnostjo.
[TOC]
Struktura
Natrijev cianid tvori ion Na+ in ion CN-.
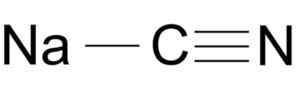 Struktura molekule natrijeve cianida Nacn. ArrowsMaster [Public Domain], Vir: Wikimedia Commons.
Struktura molekule natrijeve cianida Nacn. ArrowsMaster [Public Domain], Vir: Wikimedia Commons. Cianidni ion ima avtomobilski avtomobil in enega od dušika, ki ga združuje drug drugega s trojno povezavo.
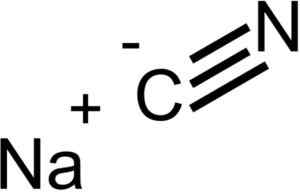 Ioni, ki sestavljajo natrijev cianid nacn. EPOP [javna domena]. Vir: Wikimedia Commons.
Ioni, ki sestavljajo natrijev cianid nacn. EPOP [javna domena]. Vir: Wikimedia Commons. NACN ima isto kristalno strukturo kot NaCl, zato so njeni kristali kubični.
Nomenklatura
-Natrijev cianid
-Natrijev cianid
Lastnosti
Fizično stanje
Higroskopska bela kristalna trdna snov (absorbira vodo iz okolja).
Molekularna teža
49,007 g/mol
Tališče
563,7 ° C
Vrelišče
1496 ° C
Plamenišče
Ni vnetljivo. Če pa je izpostavljen požaru, se pojavijo HCN vodikov cianid in dušikovi oksidi.
Vam lahko služi: sublimacija: koncept, proces in primeriGostota
1.595 g/cm3 pri 20 ° C
Topnost
Zelo topno v vodi: 48 g/100 ml pri 10 ° C, 82 g/100 ml pri 35 ° C. Rahlo topen v alkoholu
Konstanta disociacije
Hidrolizira se v vodni raztopini, ki ustvarja HCN vodikov cianid. Konstanta te hidrolize je kh = 2,5 x 10-5.
ph
Nacn vodne raztopine so močno alkalne
Kemične lastnosti
Ko se raztaplja v vodi, se loči v svojih ioni+ in CN-. V vodni raztopini cianidni ion CN- Vzemite proton h+ vode h2Ali oblikovanje hcn in OH ion-, Torej rešitev postane alkalna.
Cn- + H2O → hcn + oh-
Zaradi tega se njihove vodne raztopine hitro razgradijo tako, da ostanejo shranjene in tvorijo HCN vodikov cianid.
Je jedko do aluminija. Njegove rešitve zlahka raztopijo AU in Silver Ag v prisotnosti zraka.
To je kelacijsko sredstvo, ker cianidni anion cn- Z lahkoto se lahko pridruži drugim kovinam, kot so srebro, zlato, živo srebro, cink, kadmij itd.
Predstavlja šibek vonj grenkih mandljev.
Tveganja
Je treba ravnati zelo previdno. Je zelo strupena spojina, zavira pomembne presnovne procese in vodi v smrt tako za zaužitje, vdihavanje, absorpcijo kože ali očesni stik.
Če se NACN vdihava, se raztopi v sluznici dihalnega trakta in prehaja v krvni obtok. Cianidni ion NACN ima močno afiniteto do železa v stanju oksidacije +3, to je vera železov3+.
Ko se cianid absorbira, hitro reagira z vero3+ pomembnega encima mitohondrijev celic (oksidazni citokrom), kar preprečuje izvajanje nekaterih procesov dihanja.
Zato se celično dihanje zavira ali zavira in je citotoksična hipoksija. To pomeni, da celice in tkiva ne morejo uporabljati kisika, zlasti možganov in srčnih celic.
Na ta način pride do trajnih ali smrtonosnih poškodb telesa. To se lahko zgodi tako pri ljudeh kot pri živalih.
Če zastoje krvne žile in korozija želodčne sluznice zaužijejo, poleg tega, kar je bilo že omenjeno.
Vam lahko služi: Justus von Liebig Natrijev cianid nacn lahko povzroči smrt. Avtor: OpenIcons. Vir: Pixabay.
Natrijev cianid nacn lahko povzroči smrt. Avtor: OpenIcons. Vir: Pixabay. Ni gorivo, toda v stiku s kislinami sprošča HCN, ki je zelo vnetljiv in strupen.
Če se topi z nitritom ali klorati, lahko izkorišča.
Pridobivanje
Dobimo ga lahko z natrijevim na, amonijak NH3 in premog c. Natrij reagira z amonijakom, ki daje natrij nanh2:
2 Na + 2 NH3 → 2 Nanh2 + H2↑
Natrijev amid segrevamo z ogljikom pri 600 ° C in proizvaja natrijev cianamid NA2NCN, ki nato s premog pri 800 ° C postane natrijev cianid:
2 Nanh2 + C → 2 h2↑ + na2NCN
Na2NCN + C → 2 NACN
Druga metoda je taljenje kalcija in premoga cianamida C z natrijevim karbonatom NA2Co3:
CANCN + C + NA2Co3 → Caco3 + 2 Nacn
Pripravimo ga lahko tudi s prehodom dušikovega plina N2 za vročo mešanico natrijevega karbonata2Co3 in premog c v prahu, ki uporablja vero vere kot katalizator ali pospeševalnik reakcije:
Na2Co3 + 4 C + N2 → 2 NACN + 3 CO ↑
Prijave
Pri ekstrakciji zlatih in srebrnih mineralov. Posledice
Natrijev cianid že dolgo uporabljamo za pridobivanje zlata in srebrnih kovin iz svojih mineralov.
Cianid, ki se uporablja v postopku.
Ptice, netopirji in druge živali, ki pijejo iz teh lagun s cianidom.
Obstajajo zapisi o jezu Romunije, ki je izoliral odpadni ribnik in ga je poškodoval vremenski dogodek.
Posledično so bile na tone cianida izpuščene v reko Sasar in bližnje sisteme vodonosnikov, kot so Lapus, Somes, Tisza Rivers, ki se je končalo v Donavi.
To je povzročilo slap smrti živali ali z drugimi besedami, ekološka katastrofa.
 Ekstrakcija zlata s cianidom na Novi Zelandiji okoli leta 1918. Vidite količino onesnažene vode, ki je bila izpuščena v bližnjih rekah. Nacionalna knjižnica NZ na občini [brez omejitev]. Vir: Wikimedia Commons.
Ekstrakcija zlata s cianidom na Novi Zelandiji okoli leta 1918. Vidite količino onesnažene vode, ki je bila izpuščena v bližnjih rekah. Nacionalna knjižnica NZ na občini [brez omejitev]. Vir: Wikimedia Commons. Pri proizvodnji drugih kemičnih spojin
Natrijev cianid NACN se uporablja pri sintezi različnih vrst organskih spojin.
Vam lahko služi: natrijev oksid (NA2O): struktura, formula, lastnosti, tveganjaNa primer, pripravljeni so pigmenti in barvila (vključno z optičnimi laki), spojinami za uporabo v kmetijstvu ali agrokemikaliji in različnih farmacevtskih izdelkih.
Služi tudi za pridobivanje kelacijskih ali ugrabitvenih sredstev kovinskih ionov.
Z natrijevim cianidom pripravimo spojine, imenovane nitrile, ki pri zdravljenju s kislo kislino ali alkalno vodno raztopino omogočajo pridobivanje karboksilnih kislin.
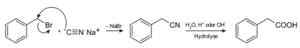 Priprava karboksilne kisline z uporabo natrijevega cianida NACN. Roland Mattern [javna domena]. Vir: Wikimedia Commons.
Priprava karboksilne kisline z uporabo natrijevega cianida NACN. Roland Mattern [javna domena]. Vir: Wikimedia Commons. Omogoča pripravo maščobnih kislin s ciano skupin, težkimi kovinskimi cianidi in vodikovim cianidom HCN.
V kovinski industriji
Nacn se uporablja v raztopinah, ki se uporabljajo v galvanoplastiki ali kovinski elektrodi (kovinska prevleka z drugimi), na primer cink.
Je sestavni del utrjenega jekla. Služi tudi pri čiščenju kovin.
V drugih uporabi
Natrijev cianid je posrednik pri proizvodnji najlona.
Uporablja se za ločevanje mineralov s flotacijo s peno.
Aplikacije brez uporabe, vprašljive ali zelo redke
Država je bila uporabljena za odpravljanje glodalcev, kot so zajci in podgane in njihove zakopa.
Trenutno se občasno uporablja za odpravljanje kojotov, lisic in divjih psov. Uporablja se v obliki kapsul kot preprost ali več odmerkov v pašnih deželah, lovu in gozdovih.
Zaradi svoje skrajne strupenosti morajo NACN uporabljati samo pripravljeni ljudje.
Ta uporaba velja za zelo nevarno za človeka, vendar obstajajo tisti, ki jo še vedno uporabljajo.
 Divje življenje ne bi smeli odpraviti, saj se te živali že borijo za preživetje v težkih pogojih. Avtor: Maxwdhs. Vir: Pixabay.
Divje življenje ne bi smeli odpraviti, saj se te živali že borijo za preživetje v težkih pogojih. Avtor: Maxwdhs. Vir: Pixabay. V kmetijstvu so ga prej uporabljali za izpiranje sadnih dreves citrusov in drugega sadja. Uporabljali so ga tudi kot insekticid in miticid (eliminator pršic), ki ga je treba uporabiti po obiranju, za ne -kamniti citrusi ali za zatiranje tovornjakov, ki se uporabljajo za njihovo prevoz. Uporabljali so ga tudi za fumigacijo ladij, železniških avtomobilov in skladišč.
Vse te uporabe je podvomila z visoko strupenostjo natrijevega cianida. Zaradi tega se ne uporablja več ali le zelo redko in pod zelo nadzorovanimi pogoji.
Reference
- Ali.S. Nacionalna knjižnica medicine. (2019). Natrijev cianid. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Kirk-Othmer (1994). Enciklopedija kemijske tehnologije. Četrta izdaja. John Wiley & Sons.
- Hurst, h.In. in Martin, m.D. (2017). Toksikologija. Cianid. V farmakologiji in terapevti za zobozdravstvo (sedma izdaja). Okrevano od Scientirect.com.
- Coppock, r.W. in Dziwenka, m. (2015). Grožnje za prostoživeče živali s pomočjo kemičnih vojn. V priročniku za toksikologijo kemičnih vojskovanja (druga izdaja). Okrevano od Scientirect.com.
- Morrison, r.T. in Boyd, r.N. (2002). Organska kemija. 6. izdaja. Prentice-Hall.
- « Struktura žveplovega trioksida (SO3), lastnosti, tveganja, uporabe
- Struktura barijev oksida (BAO), lastnosti, uporabe, tveganja »

