Struktura žveplovega trioksida (SO3), lastnosti, tveganja, uporabe
- 4450
- 65
- Cary Goyette
On Trioksid žvepla Gre. Njegova molekularna formula je tako3. Pri sobni temperaturi SO3 Je tekočina, ki oddaja pline v zraku.
Struktura SO3 Plinasta je ravna in simetrična. Trije kisik se nahajajo pravično okoli žvepla. SO3 Silovito reagira z vodo. Reakcija je eksotermična, kar pomeni, da se toplota proizvaja, z drugimi besedami, veliko se segreva.
 Molekula žveplovega trioksida tako3. Avtor: Benjah-BMM27. Vir: Wikimedia Commons.
Molekula žveplovega trioksida tako3. Avtor: Benjah-BMM27. Vir: Wikimedia Commons. Ko SO3 Tekočina se ohladi, postane trdna snov, ki ima lahko tri vrste strukture: alfa, beta in gama. Najbolj stabilna je alfa v obliki plasti skupaj med seboj, ki predstavljajo omrežje.
Za pripravo kajenja žveplove kisline, imenovane tudi olje, se uporablja za olje ali mastno podobnost plinasto žveplovi trioksid. Druga od njenih pomembnih aplikacij je v sulfoniranju organskih spojin, to je dodajanje skupin -tako3- do teh. Tako lahko med drugim pripravimo koristne kemikalije, kot so detergenti, barvila, pesticidi.
SO3 Je zelo nevaren, lahko povzroči resne opekline, oči in poškodbe kože. Prav tako ga ne smemo vdihavati ali zaužiti, ker lahko povzroči smrt z notranjimi opeklinami, v ustih, požiralniku, želodcu itd.
Zaradi teh razlogov je treba manipulirati z veliko previdno. Nikoli se ne smete obrniti na vodo ali gorljive materiale, kot so les, papir, tkanine itd., No, ogenj lahko ustvarite. Prav tako ga ne smemo zavreči ali kanalizacije zaradi nevarnosti eksplozije.
SO3 Plino, ustvarjene v industrijskih procesih.
[TOC]
Struktura
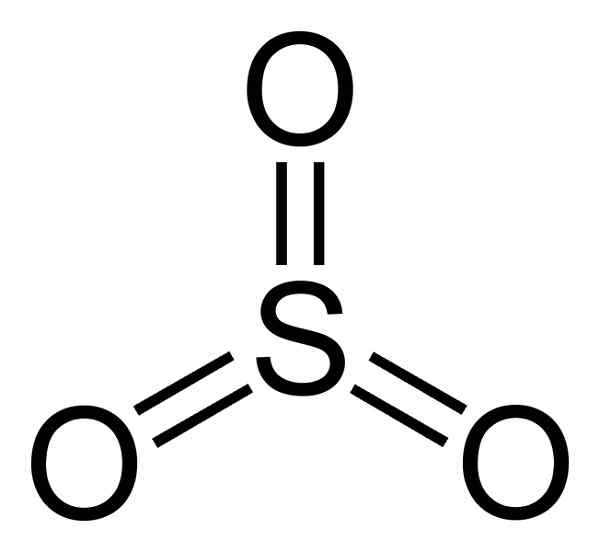
Molekula žveplovega trioksida tako3 V plinastem stanju ima ravno trikotno strukturo.
To pomeni, da v isti ravnini najdemo tako žveplo kot trije kisik. Poleg tega je porazdelitev kisika in vseh elektronov simetrična.
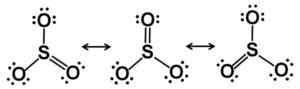 Lewis Resonance Starcutures. Elektroni so pravično razporejeni v SO3. Avtor: Marilú Stea.
Lewis Resonance Starcutures. Elektroni so pravično razporejeni v SO3. Avtor: Marilú Stea. V trdnem stanju so znane tri vrste SO strukture3: Alfa (α-so3), beta (β-so3) in gama (γ-so3).
Gama tvorba γ-so3 Vsebuje ciklične trimese, to je tri enote SO3 skupaj tvori ciklično ali obročno molekulo.
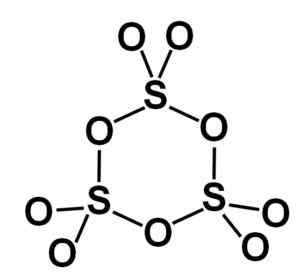 Molekula obroča trdnega žveplovega trioksida gama. Avtor: Marilú Stea.
Molekula obroča trdnega žveplovega trioksida gama. Avtor: Marilú Stea. Faza beta β-tako3 Ima neskončne spiralne verige kompozicije tetraedre4 združeni drug z drugim.
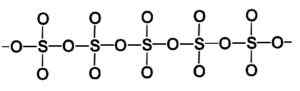 Struktura trdnega žveplovega trioksida beta. Avtor: Marilú Stea.
Struktura trdnega žveplovega trioksida beta. Avtor: Marilú Stea. Najbolj stabilen način je alfa α-So3, Podobno kot beta, vendar s strukturo plasti, pri čemer združene verige tvorijo omrežje.
Nomenklatura
-Trioksid žvepla
-Žveplov anhidrid
-Žveplov oksid
-SW3 Gama, γ-So3
-SW3 Beta, β-So3
-SW3 Alfa, α-So3
Fizične lastnosti
Fizično stanje
Pri sobni temperaturi (približno 25 ° C) in atmosferskem tlaku3 To je brezbarvna tekočina, ki oddaja hlape v zraku.
Ko SO3 Tekočina je čista pri 25 ° C je mešanica SO3 monomerna (ena sama molekula) in trimerna (3 vezane molekule) formule S3Tudi9, tako imenovano tako3 Gama γ-So3.
Lahko vam služi: Rankine Scale: kaj je, konverzije, primeriPri spuščanju temperature, če SO3 Čista je, ko doseže 16,86 ° C, utrdi ali zamrzne γ-So3, Imenuje se tudi "Torej led3".
Če vsebuje majhne količine vlažnosti (tudi izjemno majhne sledi ali količine)3 Polimerizira beta β-So3 ki tvori kristale s svilnato svetlostjo.
Potem se tvori več sindikatov z ustvarjanjem α-tako strukture3, ki je kristalna trdna v obliki igel, ki spominja na azbest ali azbest.
Ko alfa in beta talina ustvarita gama.
Molekularna teža
80,07 g/mol
Tališče
SW3 Gama = 16,86 ° C
Trojna točka
To je temperatura, pri kateri so prisotna tri fizična stanja: trdna, tekočina in plinasta. V alfa obliki je trojna točka na 62,2 ° C, v beta pa pri 32,5 ° C.
S segrevanjem alfa oblike ima to večjo nagnjenost k sublimiziranju kot taljenja. Sublimimar pomeni prehod iz trdnega stanja do sode, ne da bi šel skozi tekoče stanje.
Vrelišče
Vse oblike SO3 zavre pri 44,8 ° C.
Gostota
SO3 Tekočina (gama) ima gostoto 1.9225 g/cm3 pri 20 ° C.
SO3 Plinast ima gostoto 2,76 glede na zrak (zrak = 1), kar kaže, da je težji od zraka.
Parni tlak
SW3 Alfa = 73 mm Hg pri 25 ° C
SW3 Beta = 344 mm Hg pri 25 ° C
SW3 Gama = 433 mm Hg pri 25 ° C
To pomeni, da oblika gama ponavadi izhlapi lažje kot beta in to alfa.
Stabilnost
Alfa oblika je najbolj stabilna struktura, ostali so metastabilni, torej so manj stabilni.
Kemične lastnosti
SO3 Energično reagira z vodo, da da žveplovo kislino h2SW4. Pri reakciji obstaja zelo toplota, tako da se vodna para hitro odlepi od mešanice.
Biti izpostavljen zraku3 hitro absorbirajo vlago, oddajajo goste hlape.
To je zelo močno dehidrtno sredstvo.
Žveplo SO3 Ima afiniteto za proste elektrone (torej elektrone, ki niso v povezavi med dvema atoma), zato se nagiba k kompleksom s spojinami, ki jih imajo, kot so piridin, trimetilamin ali dioksan.
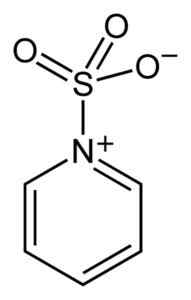 Kompleks med žveplovim trioksidom in piridinom. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons.
Kompleks med žveplovim trioksidom in piridinom. Benjah-BMM27 [javna domena]. Vir: Wikimedia Commons. Z oblikovanjem kompleksov je Sulfur "izposodil" elektrone druge spojine, da bi zadovoljil njihovo pomanjkanje. Žveplov trioksid je še vedno na voljo v teh kompleksih, ki se uporabljajo v kemičnih reakcijah, da bi to zagotovili3.
To je močan sulfonant reagent organskih spojin, kar pomeni, da lahko enostavno dodaja skupino -tako3- Do molekul.
Z lahkoto reagira z oksidi številnih kovin, da bi dali sulfate teh kovin.
Jed je za kovine, živali in rastlinska tkiva.
SO3 Težko je ravnati iz več razlogov: (1) Njegova vrelišče je razmeroma nizka, (2) ima nagnjenost k tvorbi trdnih polimerov pri temperaturah, manjših od 30 ° C in (3) ima visoko reaktivnost do skoraj vseh organskih snovi In voda.
Vam lahko služi: amorfne trdne snovi: struktura, lastnosti, primeriLahko eksplozivno polimerizira, če ne vsebuje stabilizatorja in je prisotna vlaga. Kot stabilizatorji se uporabljajo dimetilsulfat ali bonski oksid.
Pridobivanje
Dobimo z reakcijo pri 400 ° C med žveplovim dioksidom tako2 in molekularni kisik oz2. Vendar je reakcija zelo počasna in za povečanje hitrosti tega so potrebni katalizatorji.
2 Torej2 + Tudi2 ⇔ 2 Torej3
Med spojinami, ki pospešijo to reakcijo, so platino kovinski PT, vanadijev pentoksid V2Tudi5, Železni oksid2Tudi3 in dušikov oksid.
Prijave
Pri pripravi olja
Ena od njegovih glavnih aplikacij je pripravljanje oljne ali dimne žveplove kisline, imenovane, ker oddaja vidne hlape na golo oko. Da bi ga pridobili, se tako absorbira3 V koncentrirani žveplovi kislini h2SW4.
 Pu -sulfurni oleum ali kajenje. Lahko vidite beli dim, ki prihaja iz steklenice. W. Oelen [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
Pu -sulfurni oleum ali kajenje. Lahko vidite beli dim, ki prihaja iz steklenice. W. Oelen [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons. To se naredi v posebnih stolpih iz nerjavečega jekla, kjer je koncentrirana žveplova kislina (ki je tekočina)3 Gaseous gre gor.
Tekočina in plin prideta v stik in se pridružita in tvorita oleum, ki je mastna tekočina. To ima mešanico h2SW4 In tako3, ima pa tudi molekule disulfrinske kisline h2S2Tudi7 in trisulfuric h2S3Tudi10.
V kemičnih reakcijah sulfoniranja
Sulfonation je ključni postopek v velikih industrijskih aplikacijah za proizvodnjo detergentov, površinsko aktivnih snovi, barvil, pesticidov in farmacevtskih izdelkov.
SO3 Služi kot sulfonantni sredstvo za pripravo sulfoniranih olj in detergentov z alkil-angalom, med številnimi drugimi spojinami. Spodaj je reakcija sulfoniranja aromatične spojine:
Arh + tako3 → ARSO3H
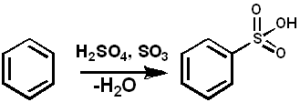 Benzensko sulfoniranje s SO3. Pedro8410 [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
Benzensko sulfoniranje s SO3. Pedro8410 [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons. Za reakcije sulfoniranja se lahko uporabi olej ali tako3 v obliki svojih kompleksov s piridinom ali trimetilaminom, med drugim.
Pri ekstrakciji kovin
Plin s3 Uporablja se pri zdravljenju mineralov. Preprosti kovinski oksidi lahko pri zdravljenju s tem postanejo veliko bolj topni sulfati3 pri razmeroma nizkih temperaturah.
Žveplovi minerali, kot je pirit (železni sulfid), trakt3 Te kovine omogoča enostavno in z nizkimi stroški.
Sulfidi iz železa, niklja in bakra reagirajo s tako plinom3 Tudi pri sobni temperaturi, ki tvorijo ustrezne sulfate, ki so zelo topni in so lahko podvrženi drugim procesom, da dobimo čiste kovine.
V več uporabi
SO3 Služi za pripravo klorosulfurinske kisline, imenovane tudi klorosulfonska kislina HSO3Cl.
Žveplov trioksid je zelo močan oksidant in se uporablja pri eksplozivni proizvodnji.
Tveganja
Do zdravja
SO3 To je zelo strupena spojina po vseh poteh, torej vdihavanju, zaužitju in stiku s kožo.
Irtita in korodira sluznice. Povzroča kožo in oči. Njegovi hlapi so zelo strupeni, ko jih vdihava. Nastajajo notranje opekline, težave z dihanjem, bolečine v prsih in pljučni edem.
Vam lahko služi: butanone: struktura, lastnosti in uporabe Žveplov trioksid SO3 je zelo jed in nevaren. Avtor: OpenIcons. Vir: Pixabay.
Žveplov trioksid SO3 je zelo jed in nevaren. Avtor: OpenIcons. Vir: Pixabay. Je strupena. Njegovo zaužitje ustvarja hudo opeklino, požiralnik in želodec. Poleg tega se sumi, da je karcinogen.
Požar ali eksplozija
Predstavlja požarno nevarnost, ko pridete v stik z organskimi materiali, kot so les, vlakna, papir, olje, bombaž, še posebej, če so mokri.
Obstaja tudi tveganje, če pridete v stik z bazami ali zmanjšali sredstva. Kombinirano je z eksplozivno vodo, ki tvori žveplovo kislino.
Stik s kovinami lahko proizvede vodikov plin h2 ki je zelo vnetljivo.
Izogibati se ga je treba v steklenih posoda.
Okoljski udarec
SO3 Velja za eno največjih onesnaževal, ki so prisotni v zemeljski atmosferi. To je posledica njegove vloge pri oblikovanju aerosolov in prispevka k kislemu dežju (zaradi tvorbe žveplove kisline H2SW4).
 Gozd, poškodovan zaradi kislega dežja na Češkem. Lovecz [javna domena]. Vir: Wikimedia Commons.
Gozd, poškodovan zaradi kislega dežja na Češkem. Lovecz [javna domena]. Vir: Wikimedia Commons. SO3 Nastaja v atmosferi zaradi oksidacije žveplovega dioksida tako2. Ko se SO oblikuje3 To hitro reagira z vodo, da tvori žveplovo kislino h2SW4. Po nedavnih študijah obstajajo tudi drugi mehanizmi transformacije SOS3 V atmosferi, vendar zaradi velike količine vode, ki je prisotna v tem, SO še vedno upošteva3 Predvsem spremenjen v h2SW4.
SO3 Plinski ali industrijski plinasti odpadki, ki jih vsebuje. Gre za izjemno reaktiven plin in, kot že rečeno zgoraj, v prisotnosti vlage zraka SO3 Postane žveplova kislina h2SW4. Zato v zraku SO3 vztraja v obliki žveplove kisline, ki tvorijo majhne kapljice ali aerosol.
Če kapljice žveplove kisline vstopijo v dihalni trakt človeka ali živali. Eden od mehanizmov s kislinsko meglo H2SW4 (to je tako3) Lahko povzroči močno strupenost, ker se spremembe zunajceličnega in znotrajceličnega pH živih organizmov (rastline, živali in človeško bitje) spreminja).
Po mnenju nekaterih raziskovalcev je tako megla3 Je vzrok za povečanje astmatike na območju Japonske. Megla tako3 Zelo koroziven vpliva na kovine, zato so kovinske strukture, ki jih je zgradil človek, kot so nekateri mostovi in konstrukcije.
SO3 Tekočine ne smete zavreči v odtoku umazanih voda ali kanalizacije. Če se vlije v kanalizacijo, lahko ustvarite nevarnost požara ali eksplozije. Če ga razlijejo po naključju, toka vode ne bi smeli usmeriti proti izdelku. Nikoli ga ne smemo absorbirati v žagovino ali drugo vpojno gorivo, saj lahko ustvari požare.
Absorbirati ga je treba v suh pesek, suho zemljo ali druge popolnoma suhe inertne absorbente. SO3 Ne bi smeli vlivati v okolje in s tem nikoli ne smete stopiti v stik. Ohraniti ga je treba daleč od vodnih virov, ker s tem proizvaja žveplovo kislino, ki škoduje vodnim in kopenskim organizmom.
Reference
- Sarkar, s. et al. (2019). Vpliv amoniaka in vode na usodo žveplovega trioksida v troposferi: teoretične raziskave poti nastajanja sulfamine in žveplove kisline. J Phys Chem a.2019; 123 (14): 3131-3141. NCBI si je opomogel.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Muller, t.L. (2006). Žveplova kislina in žveplov trioksid. Kirk-othmer Enciklopedija kemijske tehnologije. Zvezek 23. Pridobljeno iz spletne knjižnice.Wiley.com.
- Ali.S. Nacionalna knjižnica medicine. (2019). Trioksidni žveplo. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Kikuchi, r. (2001). Okoljsko upravljanje imisije žveplovega trioksida: Vpliv SO3 O zdravju ljudi. Upravljanje okolja (2001) 27: 837. Povezava je bila obnovljena.Springer.com.
- Bombaž, f. Albert in Wilkinson, Geoffrey. (1980). Napredna anorganska kemija. Četrta izdaja. John Wiley & Sons.
- Ismail, m.Yo. (1979). Ekstrakcija kovin iz sulfidov z žveplovim trioksidom v fluidizirani postelji. J. Kem. Tehnik. Biotehnol. 1979, 29, 361–366. Pridobljeno iz spletne knjižnice.Wiley.com.
- « Malavi Lago Geografija, geologija, pomen, fauna, Rios
- Struktura natrijevega cianida (NACN), lastnosti, tveganja, uporabe »

