Struktura barijev oksida (BAO), lastnosti, uporabe, tveganja

- 879
- 45
- Roman Schamberger
On barijev oksid Gre za anorgansko trdno snov, ki jo tvori barijev atom (BA) in atom kisika (O). Njegova kemična formula je Bao. Je bela kristalna trdna in je higroskopska, to je, da absorbira vlago zraka, vendar s tem reagira s tem.
Hitra reakcija barijevega oksida z vodo naredi v laboratorijih za kemijsko analizo, to je odpravljanje vode iz organskih topil, ki so tekoče spojine, ki služijo za raztapljanje drugih snovi.
 Trden bao barijev oksid. Lem [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons.
Trden bao barijev oksid. Lem [cc by-sa 4.0 (https: // creativeCommons.Org/licence/by-sa/4.0)]. Vir: Wikimedia Commons. Bao se obnaša kot močna podlaga, zato reagira s številnimi vrstami kislin. Na primer enostavno reagirati z ogljikovim dioksidom2 zraka, ki tvori barijev karbonat Bacchus3.
Služi pri izdelavi polimerov za električne kable in kot sestavina smol za zapiranje lukenj zob, ki so bile ozdravljene.
Barijev oksid (BAO) se uporablja tudi v keramični industriji, tako da ga pokrije z zasteklitvijo in za izdelavo. Uporablja se tudi v cementnih mešanicah za povečanje kompresijske odpornosti končnega izdelka.
[TOC]
Struktura
Bao baar oksid tvori kation ba2+ in kisik anion oz2-.
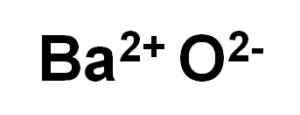 Ioni bao barijevega oksida. Avtor: Marilú Stea.
Ioni bao barijevega oksida. Avtor: Marilú Stea. V svojih kristalih BAO tvori kubične ionske mreže (v obliki kocke) tipa natrijevega klorida.
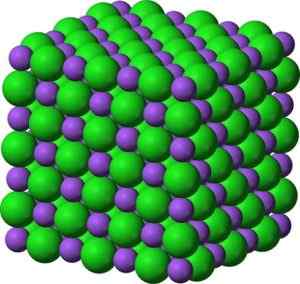 Kristalna struktura v obliki barijevega oksida, podobna natrijevemu kloridu. Zelena: Barium. Modra: kisik. Benjah-bmm27 (pogovor · prispevki) [javna domena]. Vir: Wikimedia Commons.
Kristalna struktura v obliki barijevega oksida, podobna natrijevemu kloridu. Zelena: Barium. Modra: kisik. Benjah-bmm27 (pogovor · prispevki) [javna domena]. Vir: Wikimedia Commons. Elektronska konfiguracija barijevega iona je: [xe] 6s0 No, dva elektrona 6S plasti sta izgubila. Ta konfiguracija je zelo stabilna.
Nomenklatura
-Barijev oksid
-Barijev monoksid
Lahko vam služi: test: značilnosti, vrste, primeri uporabeFizične lastnosti
Fizično stanje
Rumenkasto bela kristalna trdna.
Molekularna teža
153,33 g/mol
Tališče
1923 ° C
Vrelišče
Približno 2000 ° C.
Gostota
5,72 g/cm3
Topnost
Majhna voda topna: 3,8 g/100 ml pri 20 ° C.
Kemične lastnosti
Bario bao oksid hitro reagira2, ki je najbolj topni hidroksid med alkalineteričnimi kovinskimi hidroksidi.
Bao + h2O → ba (OH)2
Bao je močna osnova. Reagira eksotermično (torej s toplotnim odvajanjem) z vsemi vrstami kislin.
S co2 Bao reagira, da tvori barijev karbonat Bacchus3.
Bao + co2 → Bacchus3
BAO je higroskopski, ker če je dovoljen v okolje, se postopoma pridruži vlagi zraka, ki tvori BA (OH)2 ki je v kombinaciji z ogljikovim dioksidom2 zraka, da daje barijev karbonat Bacchus3.
Ko se bao barijev monoksid segreje v prisotnosti zraka, ga kombiniramo s kisikom, ki tvori kisik, barijev peroksid2. Reakcija je reverzibilna.
2 bao + o2 ⇔ 2 bao2
V prisotnosti vode lahko reagira z aluminijem na ali s FIFC Zn, ki tvori okside ali hidrokside teh kovin in ustvarja vodikov plin H2.
Lahko sprožite polimerizacijo organskih spojin, ki jih je mogoče polimerizirati, kot so epoksidi.
Tveganja
Z zaužitjem je lahko strupen. Ne smete kontaktirati kože. To je dražilne oči, kože in dihal. Lahko škoduje živčnemu sistemu. Lahko povzroči nizko raven kalija, kar ima za posledico srčne in mišične motnje.
Pridobivanje
Bao barijev oksid lahko dobimo s segrevanjem karbonata Bario Baco3 S premog. BAO se oblikuje in sprosti se ogljikov monoksidni plin.
Bacchus3 + C → BAO + 2 CO ↑
Prijave
Kot sušilna topila
Zaradi enostavnosti reakcije z vodo je bil Bao že od sredine stoletja uporabljen kot sušilec za bencin in osnovna organska topila.
Lahko vam služi: cianhidrična kislina: molekularna struktura, lastnosti, uporabeBAO se zelo aktivno suši okoli njega, vlaga je zelo hitro, z evolucijo precej toplote, ki tvori barijev hidroksid BA (OH)2 ki je stabilen do približno 1000 ° C. Zato se lahko BAO uporablja pri visokih temperaturah.
Ima tudi visoko absorpcijsko sposobnost vode. Za vsako molekulo BAO lahko absorbira vodo in BA (OH)2 Rezultat lahko absorbira tudi določeno količino vode.
Primerno je za analitične kemijske laboratorije. Ni lepljivo.
Uporablja se lahko v esikatorjih, ki so velike steklene posode s pokrovom, kjer se vzdržuje suha notranja atmosfera. BAO ohranja miniatmosfero suhega eksikatorja.
 Distinters v laboratoriju. Trdna snov, kot je BAO, je nameščena na dnu dna. Prvotni nalagalec je bil Rifleman 82 pri angleški Wikipediji. [CC BY-SA 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]]. Vir: Wikimedia Commons.
Distinters v laboratoriju. Trdna snov, kot je BAO, je nameščena na dnu dna. Prvotni nalagalec je bil Rifleman 82 pri angleški Wikipediji. [CC BY-SA 3.0 (http: // creativeCommons.Org/licence/by-sa/3.0/]]. Vir: Wikimedia Commons. Ti sušilci služijo postavljanju snovi ali reagentov in tako preprečujejo, da bi iz okolja absorbirali vodo.
Služi tudi za sušenje osnovnih plinov, kot je amonijak NH3.
Pri prenosnih svetilkah
BAO je postavljen v elektrode izpuščenih svetilk kot elektronski oddajanje materiala.
Izpuščene svetilke tvorijo steklena cev, kremen ali drug primerni material, vsebujejo inertni plin in v večini primerov kovinska para. Kovinska para je lahko natrij ali živo srebro.
 Živosrebrna svetilka. Dmitrij G [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
Živosrebrna svetilka. Dmitrij G [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons. Znotraj cevi se pojavi električni šok, ker ima pozitivno in negativno elektrodo.
BAO je nameščen v svetilko. Elektroni, ki se oddajajo, trčijo v kovinske atome pare in prenašajo energijo.
Lahko vam služi: cupric oksid (cuo)Pri prehodu električnega toka skozi ta plin ali paro obstaja vidna svetloba ali ultravijolično sevanje (UV).
V proizvodnji keramike
BAO se uporablja v sestavkih za zastekljeno keramično prevleko.
 Prevlečena gradbena fasada z zastekljeno keramiko. Penny Mayes/glazirana fasada. Vir: Wikimedia Commons.
Prevlečena gradbena fasada z zastekljeno keramiko. Penny Mayes/glazirana fasada. Vir: Wikimedia Commons. Vendar je bil tudi pri pripravi kuhalne plošče preizkušen kot dodatek.
BAO učinkovito izboljšuje mehanske značilnosti in kemično odpornost te vrste keramike. Močno vpliva na toplotne lastnosti in sestavo kristalne faze pridobljenih materialov.
Pri pripravi cementnih mešanic
BAO je bil testiran kot sestavni del fosfoaluminatnega cementa.
Ta vrsta cementa je uporabna v morskih okoljih, saj nima enake nagnjenosti k hidriranju kot druge vrste cementa, zato ne trpi zaradi pora ali širitve.
Vendar pa je treba v njihovih mehanskih zmogljivostih okrepiti fosfoaluminacijske cemente, da bodo lahko zdržali morske tokove in udarce lebdečih kosov ledu, ki so prisotni v oceanu.
Dodajanje BAO k fosfoaluminacijskemu cementu spremeni mineralno strukturo omenjenega materiala, izboljša strukturo pore in znatno poveča tlačno silo cementne paste.
Z drugimi besedami, BAO izboljšuje kompresijsko odpornost te vrste cementa.
 Mešajte za beton. Bao barijev oksid je koristen za izboljšanje določenih lastnosti cementa. Thamizhpparithi maari [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons.
Mešajte za beton. Bao barijev oksid je koristen za izboljšanje določenih lastnosti cementa. Thamizhpparithi maari [cc by-sa 3.0 (https: // creativeCommons.Org/licence/by-sa/3.0)]. Vir: Wikimedia Commons. V več aplikacijah
Uporablja se kot sestavina za zagotavljanje motnosti v zobnih smolah za polnjenje lukenj v zobeh, ki jih izvajajo zobozdravniki.
Uporablja se tudi kot nukleacijsko sredstvo za pripravo poliviniliden fluoridnih polimerov, ki se uporabljajo za izolacijo električnih kablov.
Reference
- Partyka, J. et al. (2016). Vpliv dodajanja BAO na sintranje steklo-keramičnih materialov iz SIO2-Do2Tudi3-Na2V REDU2O-cao/mgO sistem. J Therm Anal Calim (2016) 125: 1095. Povezava je bila obnovljena.Springer.com.
- Zhang, str. et al. (2019). Vpliv BAO na mineralno strukturo in hidratacijsko obnašanje fosfoaluminatnega cementa. J Therm Anal Calim (2019) 136: 2319. Povezava je bila obnovljena.Springer.com.
- Ali.S. Nacionalna knjižnica medicine. (2019). Oksidni barij. Okrevano od PubChema.NCBI.NLM.ameriški nacionalni inštitut za zdravje.Gov.
- Smith, n.Do. (2003). Osvetlitev. Načelo. V referenčni knjigi elektrotehnike (šestnajsta izdaja). Okrevano od Scientirect.com.
- Ebnejjad, s. (2003). Fluoropolimerne pene. PVDF penjenje. V obdelovalni fluoroplastiki taline. Okrevano od Scientirect.com.
- Booth, h.S. in McIntyre, L.H. (1930). Barijev oksid kot sušnik. Ind. Eng. Kem. Analno. Ed. 1930, 2, 1, 12-15. Okrevani iz lokalov.Acs.org.
- « Struktura natrijevega cianida (NACN), lastnosti, tveganja, uporabe
- 15 najboljših živil za povečanje zadnjice (naravno) »

