Formalna obremenitev
- 767
- 119
- Adrian Legros
Kaj je formalna obremenitev?
The Formalna obremenitev (Cf) je tisti, ki je dodeljen atomu molekule ali iona, ki omogoča razlago njegovih struktur in kemijskih lastnosti, odvisno od tega. Ta koncept pomeni upoštevanje največjega značaja kovalentnosti v povezavi A-B; Se pravi, par elektronov se deli enako med A in B.
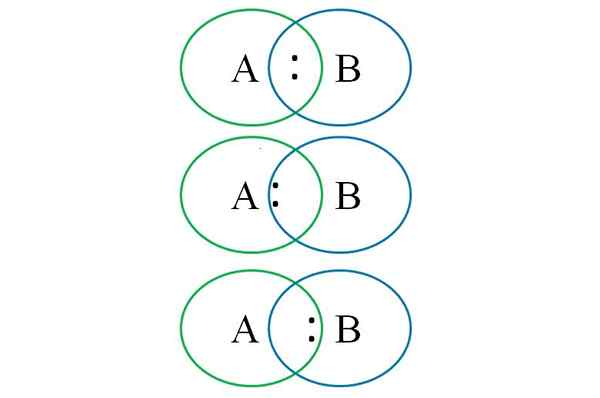
Če želite razumeti zgornje na spodnji sliki. Kot je razvidno, se v prestrezanju krogov oblikuje povezava s parom ":". V tej heteronuklearni molekuli, če imata A in B enake elektronegativnosti, navor ":" ostane enako oddaljen tako A kot B.

Glede na to, da dva različna atoma ne moreta imeti enakih lastnosti, je par privlačen, na katerega je bolj elektronegativna. V tem primeru, če je A bolj elektronegativen kot B, je par ":" bližje tistemu B. Nasprotno se zgodi, ko je B bolj elektronegativen kot A, zdaj se približuje ":" A B.
Nato je treba za dodelitev formalnih nabojev A in B razmisliti o prvem primeru (tisti nad sliko). Če bi se čisto kovalentna povezava A-B zlomila, bi prišlo do homolitičnega razpada, ki ustvari proste radikale A · in · B.
Kvalitativne prednosti uporabe formalne obremenitve
Elektroni niso fiksni, kot v prejšnjem primeru, vendar potujejo in izgubijo atomi molekule ali iona. Če gre za diatomsko molekulo, je znano, da je treba par ":" deliti ali potekati med obema atomama; Enako se zgodi v molekuli tipa A-B-C, vendar z večjo zapletenostjo.
Ko pa atom preučujemo in v svojih povezavah prevzamemo stoodstotno kovalenco, je lažje ugotoviti, ali znotraj sestavljenih zmag ali izgubi elektrone. Če želite določiti ta dobiček ali izgubo, je treba vaše bazalno ali svobodno stanje primerjati z vašim elektronskim okoljem.
Vam lahko služi: Amagat zakon: Pojasnilo, primeri, vajeNa ta način je mogoče dodeliti pozitivno obremenitev (+), če atom izgubi elektron ali negativno obremenitev (-), ko v nasprotnem primeru zmaga elektron (znaki morajo biti zapisani znotraj kroga).
Čeprav elektronov ni mogoče natančno namestiti, se te formalne obremenitve (+) in (-) v strukturah v večini primerov prilagodijo pričakovanim kemičnim lastnostim.
To pomeni, da je formalna obremenitev atoma tesno povezana z molekularno geometrijo njegovega okolja in reaktivnostjo znotraj spojine.
Formula in kako jo izračunati
So formalne obremenitve poljubno dodeljene? Odgovor je ne. Za to je treba izračunati dobiček ali izgubo elektronov s predpostavko izključno kovalentnih vezi in to dosežemo z naslednjo formulo:
Cf = (številka atoma) - (število povezav, ki oblikujejo) - (število razpakiranih elektronov)
Če ima atom CF z vrednostjo +1, je dodeljena pozitivna obremenitev ( +); Če imate CF z vrednostjo -1, se nato dodeli negativna obremenitev ( -).
Za pravilno izračun CF je treba korake upoštevati spodaj:
- Poiščite, katera skupina je atom v periodični tabeli.
- Preštejte število povezav, ki se tvorijo s sosedi: dvojne povezave (=) so vredne dve, trojne povezave pa so vredne tri (≡).
- Končno štejemo število elektronov, ki jih ni deljeno, kar je enostavno opaziti s strukturami Lewis.
Spremembe izračuna glede na strukturo
Glede na linearno molekulo A-B-C-D se lahko formalne obremenitve za vsak atom spreminjajo, če je na primer struktura na primer napisana kot: B-C-A-D, C-A-B-D, A-C-D-B itd. To je zato, ker obstajajo atomi, ki z deljenjem več elektronov (tvori več obveznic) pridobijo pozitiven ali negativni CF.
Lahko vam služi: meniskus (kemija)Torej, katera od treh možnih molekulskih struktur ustreza spojini ABCD? Odgovor je: tisti, ki ima na splošno najnižje vrednosti CF; Tudi tisti, ki dodeli negativne obremenitve (-) najbolj elektronegativnim atomom.
Če sta C in D bolj elektronegativna kot A in B, potem z deljenjem več elektronov pridobita pozitivne formalne obremenitve (ki jih vidimo iz mnemoničnega pravila).
Tako je najbolj stabilna struktura in najbolj naklonjena energija, C-A-B-D, saj tako v C kot B tvorijo samo eno povezavo. Po drugi strani pa sta struktura A-B-C-D in tisti, ki imata C ali B, ki tvorita dve povezavi (-C- ali -D-), bolj nestabilna.
Katera od vseh struktur je najbolj nestabilna? A-C-D-B, ker ne samo C in D tvorita dve povezavi, ampak tudi njihove negativne formalne obremenitve (-) med seboj, kar še dodatno destabilizira strukturo.
Primeri formalnih izračunov obremenitve
Bf4- (Tetrafluoroborato ion)
Atom bora je obdan s štirimi atomi fluora. Ker B pripada skupini IIIA (13), nima skupnih elektronov in tvori štiri kovalentne vezi, je njen CF (3-4-0 = -1). Namesto za F, element skupine VIIA (17), je njen CF (7-6-1 = 0).
Če želite določiti obremenitev iona ali molekule, je dovolj, da dodate posamezne CFS atomov, ki ga sestavljajo: (1 (-1) + 4 (0) = -1).
Vendar CF za B nima pravega pomena; To je, ker to ne prebiva največje elektronske gostote. Pravzaprav je ta elektronska gostota razporejena na štiri atome F, veliko več elektronegativnega elementa kot B.
Vam lahko služi: šibka kislinaBeh2 (berilijev hidrid)
Atom berilija spada v skupino IIA (2), tvori dve povezavi in spet ne primanjkuje ne skupnih elektronov. Tako sta CF za BE in H:
PrimBiti= 2-2-0 = 0
PrimH= 1-1-0 = 0
Beh obremenitev2= 1 (0) + 2 (0) = 0
Co (ogljikov monoksid)
Njegova struktura Lewisa je lahko predstavljena kot: C≡O: (čeprav predstavlja druge resonančne strukture). Ponavljanje izračuna CF, tokrat za C (skupine DDV) in O (via skupine), imate:
PrimC= 4-3-2 = -1
PrimTudi= 6-3-2 = +1
To je primer, ko formalni naboji ne ustrezajo naravi elementov. Ali je bolj elektronegativen od C in zato ne sme imeti pozitivnega.
Druge strukture (c = o in (+Co(-)), čeprav ustrezajo skladni razporeditvi obremenitev, ne upoštevajo pravila okteta (C ima manj kot osem elektronov Valencije).
Nh4+ (ionski amonij), NH3 in nh2- (amiduro ion)
Več elektronov deli n, bolj pozitiven je njen CF (za amonijev ion, saj nima razpoložljivosti energije, da bi oblikoval pet vezi).
Uporaba izračunov za n amonij, amoniak in amiduro ion, potem pa imajo:
CF = 5-4-0 = +1 (NH4+)
CF = 5-3-2 = 0 (NH3)
In končno:
CF = 5-2-4 = -1 (NH2-)
To je v NH2- N ima štiri ne skupne elektrone in deli vse, ko tvori NH4+. CF za h je enak 0 in zato je vaš izračun shranjen.

