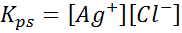Zakon o množičnih ukrepih

- 5000
- 1202
- Cary Goyette
 Reakcija padavin vključuje ravnovesje topnosti, ki ga ureja zakon o množičnih ukrepih
Reakcija padavin vključuje ravnovesje topnosti, ki ga ureja zakon o množičnih ukrepih Kaj je zakon o množičnih ukrepih?
The Zakon o množičnih ukrepih navaja, da je hitrost reakcije odvisna od koncentracije njegovih reaktantov, dvignjenih na njegove stehiometrične koeficiente. Ta zakon omogoča povezovanje med seboj koncentracije v ravnovesju reaktantov in produktov reverzibilne kemijske reakcije. Z drugimi besedami, vzpostavlja formulo ravnotežne konstante.
Zakon o množičnih ukrepih so izpovedali norveški (in kremni) kemiki Cato M. Guldberg (1836-1902) in Peter Waage (1833-1900) leta 1864. To je eden temeljnih zakonov kemije, saj nam omogoča izračun končnih koncentracij v ravnovesju iz začetnih količin.
Poleg tega nam množični zakon omogoča tudi enostavno razumevanje učinkov sprememb koncentracij katere koli vrste na ravnovesje. Z drugimi besedami, omogoča, da razumemo, kako delujejo načela Le Chatlierja.
Kljub temu, da se imenuje "zakon o množičnih ukrepih", se v resnici ne nanaša na množice reaktantov in produktov, temveč na njihove koncentracije. Razlog, ki se imenuje zakon o množičnih ukrepih in ne zakon o koncentracijah, je v tem, da je bila koncentracija imenovana "aktivna masa".
Zakon o množičnih ukrepih in ravnotežna konstanta
Po zakonu o množičnih ukrepih, ko reverzibilne reakcije dosežejo ravnovesje, ni zato, ker se reakcija ustavi. Nasprotno, ravnotežje dosežemo, ko je hitrost neposredne reakcije enaka hitrosti obratne reakcije. Ko se to zgodi, se vse kemične vrste pojavijo in porabijo z isto hitrostjo, zato njihove koncentracije postanejo konstantne (nehajo se spreminjati).
Vam lahko služi: toluen: struktura, lastnosti, uporabe, pridobivanjeGuldberg in Waage sta odkrila, da so hitrosti obeh reakcij (neposrednih in obratnih) odvisne od molarne koncentracije (v mol/L) od njihovih reagentov, povišanih na stehiometrične koeficiente. Iz teh opazovanj jim je uspelo najti formulo za ravnotežno konstanto.
V skladu s tem zakonom za vsako reverzibilno kemijsko reakcijo, ki doseže ravnovesje,
„… Razmerje med produktom molarnih koncentracij produktov, dvignjenih na njihove stehiometrične koeficiente, in produktom molarnih koncentracij reaktantov, dvignjenih na njihove stehiometrične koeficiente, je konstantno pri določeni temperaturi konstantno."
Ta konstanta se imenuje "ravnotežna konstanta" in je predstavljena s simbolom Kc.
Ravnotežna konstantna formula
Poglejmo, kako izgleda prejšnja izjava v obliki matematične enačbe. Gre za reverzibilno kemijsko reakcijo, kot je bila predstavljena spodaj, kjer sta A in B reaktanta, C in D produkti, A, B, C in D pa so ustrezni stehiometrični koeficienti uravnotežene reakcije:
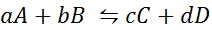
Za takšno generično reakcijo je ravnotežna konstanta podana z:
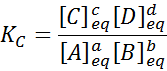
kjer so [a], [b], [c] in [d] molske koncentracije A, B, C in D v ravnovesju.
Konstanta ravnotežja v tlakih
Prejšnja formula za ravnotežno konstanto velja za kakršno koli kemijsko reakcijo, v kateri so vse snovi v isti fazi (to je, da so na primer vse v vodni fazi ali v plinski fazi). Vendar je v primeru reakcij plinske faze bolj priročno delati s pritiski kot s koncentracijami.
Ker je molarna koncentracija plinov sorazmerna z njihovim delnim pritiskom, se lahko formula ravnotežne konstante v smislu teh pritiskov prepisuje, kot sledi:
Lahko vam služi: 30 uporabe karboksilnih kislin v vsakdanjem življenju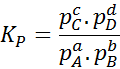
Kjer pDo, strB, strC In pD So delni pritiski A, B, C in D, A, B, C in D. V tem primeru kStr Imenuje se stalno ravnovesje pri tlakih in je povezan s KC Skozi naslednjo formulo:
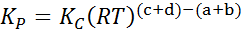
kjer je r univerzalna konstanta idealnih plinov in t je absolutna temperatura v Kelvinu.
Reakcije, ki vključujejo več kot eno fazo
Včasih kemična reakcija vključuje nastanek trdne snovi kot oborine iz raztopine ali tvorbo tekočine iz reaktantov, ki reagira v plinski fazi. V teh primerih se reakcija ne dogaja v isti fazi, zato moramo spremeniti ravnotežno konstantno formulo.
Na srečo so spremembe zelo preproste. Edino, kar moramo upoštevati pri pisanju formule ravnotežne konstante, je, da čiste snovi, ki se pojavljajo kot trdne snovi ali tekočine, ne bi smele upoštevati. Po potrebi namesto tega postavimo 1.
V zaključku zakon o množičnih ukrepih omogoča zapisovanje formule ravnotežne konstante tako v koncentracijah kot v delnih tlakih. Ko poznate enega od obeh, je drugo mogoče najti od prvega.
Končno moramo biti previdni in pregledati fazo, v kateri najdemo vse kemijske vrste, da vemo, ali jih moramo vključiti v ravnotežno konstanto.
Primeri uporabe zakona o množičnih ukrepih
V naslednjih primerih prikazujemo, kako uporabiti zakon o množičnih ukrepih za pisanje formul ravnotežnih konstant za različne vrste kemijskih reakcij.
Reakcije reakcij v plinastem stanju
Primer 1: razgradnjo n2Tudi4 V plinski fazi
N2Tudi4 To je rjav plin, ki se pokvari v skladu z naslednjo reakcijo:
Lahko vam služi: láurinska kislina: struktura, lastnosti, uporabe, koristi, učinki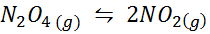
 Vzorec NO2 pri različnih temperaturah, ki prikazujejo premik ravnotežja na rjavi N2O4
Vzorec NO2 pri različnih temperaturah, ki prikazujejo premik ravnotežja na rjavi N2O4 Za to reakcijo so ravnotežne konstante v koncentracijah in pritiskih podane z:
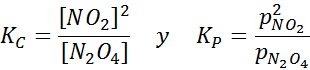
Primer 2: oksidacija ogljikovega monoksida
Ogljikov monoksid je zelo strupen plin, ki lahko postane ogljikov dioksid, ko reagira s kisikom v skladu z naslednjo reakcijo:
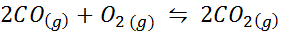
Za to reakcijo so ravnotežne konstante v koncentracijah in pritiskih podane z:
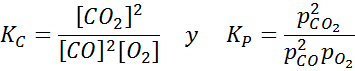
Kislinska bazna stanja v vodni fazi
Primer 3: Voda samo -dolžina
Ionsko ravnovesje vode, znano tudi kot reakcija voda, je reverzibilna reakcija med dvema molekulama vode v tekočem stanju. Reakcija je:
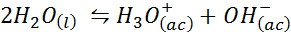
Pri pisanju ravnotežne konstante za to reakcijo moramo upoštevati, da je v tem primeru edina reagent čista tekočina, katere koncentracija je praktično konstantna. Zaradi tega ni vključen v formulo ravnotežne konstante:
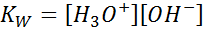
To je zelo pomembna ravnotežna konstanta, ki prejme svoje ime (konstanta ionskega produkta vode) in svoj simbol (kW. W se nanaša na vodo v angleščini, kar je rečeno toalenjak). Vendar je konstanta ravnovesja v koncentracijah kot pri vseh drugih.
Topnost
Primer 4: Srebrno ravnovesje s topnostjo s srebrnim kloridom
Ko pripravimo nasičeno raztopino, se vzpostavi ravnovesje topnosti. V tem primeru je ravnovesje raztapljanje srebrnega klorida, katerega reakcija je podana z:
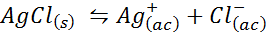
Ravnotežna konstanta te reakcije (in vseh reakcij raztopine) ne vključuje srebrnega klorida (AGCL), saj je trdna. Poleg tega, tako kot v primeru vode, tudi te konstante prejmejo posebno ime, ki je "konstantna proizvoda topnosti", predstavljeno kot K$: