Kovinski značaj
- 1938
- 100
- Lee Farrell
Kaj je kovinski lik?
On Kovinski značaj elementov Periodična tabela se nanaša na vse tiste spremenljive, kemične in fizične, ki definirajo kovine ali jih ločijo od drugih snovi narave. Običajno so svetle, goste, trde, visoke termične in električne, oblikovane in duktilne prevodnosti.
Vendar pa vse kovine ne kažejo takšnih značilnosti; Na primer, v primeru živega srebra je to svetla črna tekočina. Tudi te spremenljivke so odvisne od zemeljskega tlaka in temperaturnih pogojev. Na primer, očitno nemetalni vodik se lahko v ekstremnih pogojih fizično obnaša kot kovina.
Ti pogoji so lahko: pod Absmalnimi pritiski ali zelo hladnimi temperaturami okoli absolutne ničle. Če želite določiti, ali je element kovinski ali ne, je treba upoštevati skrite vzorce v očeh opazovalca: atomski vzorci.
Ti diskriminirajo več natančnosti in zanesljivosti, kakšni so kovinski elementi in celo kakšen element je bolj kovinski kot drugi.
Na ta način pravi kovinski značaj zlatega kovanca bolj temelji na lastnostih svojih atomov kot tistim, ki jih določa njena zlata masa, tudi oba sta tesno povezana.
Kateri od kovancev je bolj kovinski: eden od zlata, eden od bakra ali platine? Odgovor je platinast, razlaga pa leži v njenih atomih.
Kako se razlikuje kovinski značaj elementov v periodični tabeli?
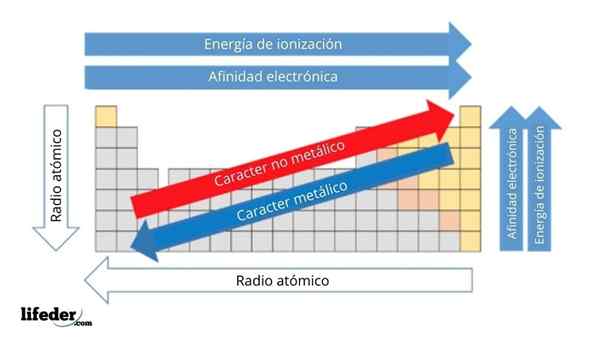
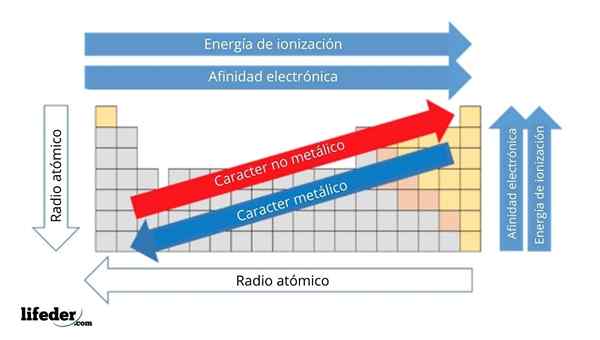
Na zgornji sliki imate periodične lastnosti elementov. Vrstice ustrezajo obdobjem in stolpcem skupinam.
Kovinski značaj se zmanjšuje od leve proti desni strani periodične tabele in se poveča v nasprotni smeri. Prav tako se kovinski značaj povečuje od vrha do dna in se zmanjšuje, ko se obdobja prenašajo v skupinske glave.
Lahko vam služi: baze: značilnosti in primeriNa ta način imajo elementi, ki so blizu smeri, v katero so puščice, večji kovinski značaj kot tisti, ki se nahajajo v nasprotni smeri (rumeni bloki).
Poleg tega druge puščice ustrezajo drugim periodičnim lastnostim, ki opredeljujejo, v kakšnem smislu se povečajo ali zmanjšajo, saj je element "kovinski". Na primer, elementi rumenih blokov, čeprav imajo nizki kovinski značaj, sta njihovi elektronski afiniteti in ionizacijska energija visoka.
V primeru atomskih radijskih sprejemnikov je večji, bolj kovinski je element; To označuje modra puščica.
Lastnosti kovinskih elementov
V periodični tabeli opazimo, da imajo kovine velike atomske radijske sprejemnike, nizke ionizacijske energije, nizke elektronske afinitete in nizke elektronegativnosti. Kako si zapomniti vse te lastnosti?
Točka, v katero tečejo, je reaktivnost (elektropozitivnost), ki definira kovine, ki oksidirajo; to pomeni, da zlahka izgubijo elektrone.
Ko izgubijo elektrone, kovine tvorijo katione (m+). Zato elementi z najvišjimi kovinskimi kationi lažje tvorijo katione kot tisti v nižjem kovinskem značaju.
Primer zgoraj je upoštevati reaktivnost elementov skupine 2, alkalinoternih kovin. Berlij je manj kovinski kot magnezij, in to je manj kovinsko kot kalcij.
Torej, dokler ne dosežete kovinskega bario, najbolj reaktivnega od skupine (po polmeru, radioaktivni element).
Kako vpliva atomski polmer na reaktivnost kovin?
Ko se atomski polmer povečuje, so Valencijevi elektroni bolj oddaljeni od jedra, zato jih v atomu zadržujejo z manj sile.
Vam lahko služi: natrijev hidroksid (NaOH): struktura, lastnosti, uporabe, sintezaČe pa se obdobje prepelje na desno stran periodične tabele, jedro svojemu telesu doda protone, ki je zdaj bolj pozitivno, kar močneje privlači valenčne elektrone, kar zmanjša velikost atomskega polmera. To ima za posledico zmanjšanje kovinskega značaja.
Tako se zelo majhen atom in z zelo pozitivnim jedrom ponavadi pridobiva elektrone, namesto da bi jih izgubili (ne -metalni elementi), tisti, ki lahko osvojijo in izgubijo elektrone, pa se štejejo za metaloides. Boron, Silicon, Germanio in Arzen so nekateri od teh metaloidov.
Po drugi strani se atomski polmer poveča tudi, če obstaja nova razpoložljivost energije za druge orbitale, ki se pojavijo, ko se spuščajo v skupino.
Zaradi tega, ko se spuščajo v periodično tabelo, radijski sprejemniki postanejo zajetni in jedro ne more preprečiti, da bi druge vrste odvzele elektrone iz svoje zunanje plasti.
V laboratoriju z močnim oksidacijskim sredstvom, podobnim razredčenim dušikovo kislino (HNO3)- kovinske reaktivnosti pred oksidacijo lahko preučimo.
Podobno so procesi tvorbe njihovih kovinskih halogenidov (na primer NACL) tudi demonstrativni poskusi te reaktivnosti.
Element večjega kovinskega značaja
 Cezij
Cezij Smer modre puščice na sliki periodične tabele vodi do elementov Francia in Cesio. Francia je bolj kovinski kot cezija, vendar je za razliko od slednjih Francio umetna in radioaktivna. Zaradi tega cezij zaseda kraj naravnega elementa večjega kovinskega značaja.
Vam lahko služi: železov oksidPravzaprav je ena najbolj znanih (in eksplozivnih) znanih reakcij tista, ki se pojavi, ko kos (ali kapljice) cezija pride v stik z vodo.
Visoka reaktivnost cezija, prevedena tudi v tvorbo veliko bolj stabilnih spojin, je odgovorna za nenadno sproščanje energije:
2cs (s) + 2h2O → 2csoh (aq) + h2(g)
Kemična enačba omogoča ogled oksidacije cezija in zmanjšanje vodnega vodika na plinasti vodik.
Element nižjega kovinskega značaja
 3D fluorski model
3D fluorski model V nasprotni diagonali, v zgornjem desnem kotu periodične tabele, fluorid (F2, Vrhunska slika) vodi seznam ne -metalnih elementov. Ker? Ker je to element v najbolj elektronegativni naravi in tisti z najnižjo ionizacijsko energijo.
Z drugimi besedami, reagira z vsemi elementi periodične tabele, da tvori ion F- in ne f+.
Fluor zelo verjetno ne bo izgubil elektronov v nekaterih kemičnih reakcijah, v nasprotju s kovinami. Zaradi tega je element nižjega kovinskega značaja.
Reference
- Lumen, kemija za ne-major. Kovinski in nemetalni značaj. Okrevano s tečajev.Lumenarning.com
- Naloga kemije. (2018). Elektropostivnost ali kovinski značaj. Okrevano od kemije.com
- Juan Ramos. Popoln seznam kovin in ne kovine. Okrevano iz ScienceTrends.com
- Anne Marie Helmerine, ph.D. Lastnosti in trendi kovinskih znakov. Opomogel od Thoughtco.com

